|
Erkrankungen von Leber, Gallenwegen,
Pankreas |
|
| Prof. Dr. Hans Huchzermeyer |
|
4. Erkrankungen des Magen-Darm-Traktes 4.1. Erkrankungen des Periodonts und der Zähne 4.1.1. Gingivitis und Periodontitis Die Gingivitis in der Schwangerschaft ist eine nicht-spezifische Entzündung der den Zähnen benachbarten Mundschleimhaut mit einem unterschiedlich ausgeprägten entzündlichen Infiltrat und einer Proliferation der Kapillaren. Das klinische Bild wird durch die hormonellen Effekte auf die oralen Gewebe wesentlich modifiziert. Auf dem Boden eines vorgeschädigten Zahnbetts kann sich eine Periodontitis entwickeln, das heißt eine Entzündung des Zahnhalteapparates einschließlich der angrenzenden Gewebe. Entzündungen der Gingiva sind während der Schwangerschaft unter den Periodontalerkrankungen am häufigsten zu beobachten. In zahlreichen Studien ist die Prävalenz mit 30 – 100 % höher als bei Nichtgraviden (4, 33, 46). Ätiologie. Die hormonell bedingten Adaptationsvorgänge in der Schwangerschaft nehmen auch den oralen Bereich nicht aus. Im Wesentlichen ist dies auf die steigende Produktion von Östrogen und Progesteron zurückzuführen. Die oralen Gewebe, speziell die Gingiva, werden zunehmend auf dem Blutwege, aber auch durch den Speichel, diesen Steroidhormonen exponiert. Darüber hinaus finden sich spezifische Rezeptoren und auch eine Metabolisierung dieser Hormone in der Gingiva. Die Folgen sind Veränderungen im Bindegewebsstoffwechsel, im lokalen Immunsystem, der subgingivalen Flora mit einer Zunahme der gramnegativen Keime sowie der gingivalen Gefäße. Besonders ausgeprägt ist die gesteigerte Vaskularisierung und Durchblutung (33). Die Gingivitis ist aber nicht allein auf diese Alterationen zurückzuführen, sondern lokal irritierende Faktoren, vor allem aber die Plaquebildungen in unterschiedlicher Zusammensetzung sind ursächlich beteiligt. Somit induziert die Schwangerschaft nicht die Gingivitis, sie vermag aber präexistente Erkrankungen zu aggravieren. Klinik. Das erste klinische Symptom einer akuten Gingivitis ist eine Rötung und Schwellung der marginalen und papillären Gingiva infolge hormonell bedingter Hyperämie und Permeabilitätssteigerung mit konsekutivem Ödem und Extravasaten von Erythrozyten (Abb. 4.1). Die entzündlichen Veränderungen, lokalisiert oder generalisiert auftretend, zeichnen sich durch eine vermehrte Verletzlichkeit und Blutungsneigung sowie durch eine Neigung zur Pseudotaschenbildung aus. Als Komplikationen kommen Periodontitiden sowie Nekrosen des Zahnfleisches zur Beobachtung. Die Gingivitis beginnt meistens im 2. Schwangerschaftsmonat, ist besonders ausgeprägt im 3. und 8. Monat, um dann im 9. Monat sich allmählich zurückzubilden. Die komplette Restitution kann bis zu einem Jahr post partum dauern (46). Bei der akuten Gingivitis ist histologisch das entzündliche Infiltrat überwiegend durch Granulozyten gekennzeichnet, bei der chronischen Verlaufsform dominieren Lymphozyten und Makrophagen.
Der Schweregrad der Entzündung ist von mehreren Faktoren abhängig. Das Ausmaß der Entzündung nimmt mit dem Alter der Schwangeren und der Anzahl der Schwangerschaften zu, besonders aber vorbestehende, eventuell unbehandelte Gingivitiden und Parodontitiden verschlechtern den Verlauf. Eine besondere Risikogruppe stellen Schwangere mit Typ I-Diabetes dar, die im Vergleich zu nichtgraviden Diabetikerinnen in der Regel stärkere gingivale Entzündungen und periodontale Destruktionen sowie größere Plaque-Scores aufweisen. Als Erklärung für diese verstärkt auftretenden Periodontalerkrankungen bei graviden Typ-I-Diabetikerinnen werden das Vorliegen von Diabetes-assoziierten mikrovaskulären Schäden, eine reduzierte Infektabwehr durch Störungen der Leukozytenfunktion wie der Stimulation des Immunsystems, Alterationen im Kollagenstoffwechsel und eine vermehrte Bildung proinflammatorischer Zytokine ursächlich diskutiert (21). Generell besteht bei Infektionen in der Geburtshilfe ein erhöhtes fetales Morbiditäts- und Mortalitätsrisiko. Dieses Faktum gilt auch für die Periodontitis, deren Bedeutung als unabhängiger Risikofaktor für Frühgeburten mit vermindertem Geburtsgewicht und fetaler Wachstumsretardierung zunehmend diskutiert wird. Speziell den unbehandelten mittelschweren bis schweren generalisierten Periodontitiden wird eine auslösende Rolle zugeschrieben. Als pathogenetische Mechanismen werden die hämatogene Translokation von periodontalen gramnegativen Bakterien oder deren Bestandteile (wie Endotoxin), von inflammatorischen Zytokinen (wie IL-1, IL-6, TNF-alpha) sowie von Prostaglandinen und Leukotrienen als aktiven Metaboliten der Arachidonsäure zum Feten bzw. zur Dezidua vermutet (4, 33, 41). 4.1.2. Schwangerschaftsgranulom Das Schwangerschaftsgranulom (Epulis gravidarum bzw. angiomatosa) ist eine spezielle lokalisierte Form der Gingivitis. Da diese Läsion klinisch und histologisch identisch ist mit den pyogenen Granulomen bei Männern und Nichtgraviden, wird auch die Bezeichnung pyogenes Granulom in der Schwangerschaft verwendet. Diese ödematöse lokale Hyperplasie sitzt der Gingiva oder der Gaumenschleimhaut gestielt oder sessil auf, häufig bukkal an den oberen Schneidezähnen. Sie wächst rasch und ist sehr kapillarreich und neigt daher leicht zu Blutungen. Ebenso ist sie meist schmerzlos, falls nicht eine Traumatisierung durch den Kauakt erfolgt. Diese gutartige Reizwucherung findet sich relativ selten (bei bis zu 5 % der Graviden) und entsteht überwiegend im 1. oder 2. Trimenon zumeist der ersten Schwangerschaft. Die Ätiologie dieser Läsion ist unbekannt. Histologisch finden sich gleichzeitig akute und chronische Entzündungsinfiltrate in einem exzessiv vaskularisierten hyperplastischen Granulationsgewebe. Ein spezieller Erregernachweis konnte bisher nicht geführt werden. Belagsbildungen oder Traumata sowie die Hormonumstellung dürften an der Entstehung des Schwangerschaftsgranuloms wesentlich beteiligt sein (4, 33). 4.1.3. Karies Es liegen bisher keine Belege dafür vor, daß die Zahnkaries, die irreversible Schädigung der Hartsubstanzen durch säurebildende und proteolytische Bakterien, durch die Schwangerschaft mit ihrer veränderten hormonellen Lage häufiger auftritt oder rascher fortschreitet. Allerdings können mehrere Faktoren zu einer kariesfördernden Konstellation beitragen. Zu nennen sind:
Es wird diskutiert, daß Streptococcus mutans durch den mütterlichen Speichel in den kindlichen Mund gelangen kann mit der Gefahr einer Kolonisation der kindlichen Zähne mit diesem kariogenen Keim. Die frühere Annahme, es komme analog zum Knochen auf dem Blutwege zum Mineralentzug aus den Zähnen, konnte nicht belegt werden (33, 46). 4.1.4. Prophylaxe und Therapie Um die oben genannten Komplikationen zu vermeiden, sollten konsequent Prophylaxemaßnahmen (häusliche Zahnpflege, professionelle Zahnreinigung und Zahnsteinentfernung) bereits vor Beginn einer Schwangerschaft durchgeführt werden. Das gleiche gilt für bereits bestehende Periodontopathien oder eine Karies, die unverzüglich behandelt werden müssen. Dies hat insbesondere auch im Interesse des Feten zu erfolgen, um das erhöhte Risiko für Frühgeburt und Mangelernährung sowie für eine spätere Kariesentwicklung zu minimieren. Auch können zu diesem Zeitpunkt noch Medikamente verordnet werden, die in der Schwangerschaft eventuell als potentiell teratogen einzustufen sind. Therapie. Beim Auftreten einer plaqueassoziierten Gingivitis oder einer leichten Parodontitis während der Schwangerschaft erfolgt therapeutisch die mechanische Belagentfernung bei gleichzeitiger Beseitigung anderer irritierender Faktoren. Gleichzeitig kann zur Unterstützung eine antiseptische Therapie mit Chlorhexidin erfolgen. Grundsätzlich ist eine konsequente Mundhygiene erforderlich (46). Bei der mittelschweren bis schweren akuten und chronischen Parodontitis, bei der nekrotisierenden Gingivitis oder Parodontitis bzw. beim Parodontalabszeß mit ausgeprägter Allgemeinsymptomatik sollten zur Unterstützung direkt im Anschluß an das supra- und subgingivale Debridement systemisch Antibiotika gegeben werden unter Beachtung der Besonderheiten in der Schwangerschaft (4, 33). Leichte Formen des pyogenen Schwangerschaftsgranuloms bilden sich nach der Entbindung entweder spontan zurück oder müssen exzidiert werden. Größere, funktionell störende oder blutende Läsionen müssen auch in der Schwangerschaft in Lokalanästhesie entfernt werden. Hinzuweisen ist auf die hohe Rezidivneigung. Die Defekte bei Karies werden in üblicher Weise behandelt. Das gleiche gilt für die Kariesfolgen wie Zahntrepanation, endodontische Behandlung, Abszeßinzision und Zahnextraktion. Ab dem 6. Monat sollten zahnärztliche Manipulationen in Kopftieflage wegen der Gefahr des Vena cava-Kompressions-Syndroms vermieden werden. Die kritische Phase für Fehlbildungen ist das 1. Trimenon. In dieser Phase dürfen die Gabe von Medikamenten und zahnärztliche Röntgenaufnahmen nur bei zwingender Indikation erfolgen. Die Strahlenbelastung für den Feten ist unter Beachtung der Strahlenschutzbestimmungen extrem gering und entspricht etwa der täglichen natürlichen Hintergrundbelastung. Informationen über die Anwendung der in der Zahnmedizin gebräuchlichen Pharmaka in Schwangerschaft und Stillperiode finden sich in der entsprechenden Spezialliteratur. 4.2. Erkrankungen des Ösophagus 4.2.1. Gastroösophageale Refluxkrankheit Unter einer gastroösophagealen Refluxkrankheit versteht man ein klinisches Bild mit Sodbrennen, Luftaufstoßen, Schluckbeschwerden oder epigastrischen Schmerzen, das durch den Reflux von Magensäure in die Speiseröhre ausgelöst wird. Bei einem Teil der Patienten besteht zusätzlich eine Refluxösophagitis, definiert durch den endoskopischen Nachweis von Mukosaläsionen. Gelegentliche Refluxbeschwerden sind physiologisch. Krankheitswert kommt den Beschwerden erst zu, wenn sie subjektiv als gravierend empfunden werden. Hauptursache ist ein insuffizienter Verschluß des gastroösophagealen Übergangs. Man unterscheidet eine primäre idiopathische Refluxkrankheit mit multifaktorieller Pathogenese von sekundären Formen als Folge einer definierten Grunderkrankung (z.B. Zustand nach Magenoperation, Magenausgangsstenose etc.). Die gastroösophageale Refluxkrankheit im Rahmen der Schwangerschaft gehört ebenfalls zu den sekundären Formen. Refluxbeschwerden gehören zu den häufigsten gastrointestinalen Symptomen. Sodbrennen als das Kardinalsymptom der Refluxkrankheit ist das Symptom, über das von seiten des Gastrointestinaltrakts auch in der Schwangerschaft am häufigsten geklagt wird. Über die Hälfte aller Schwangeren in den westlichen Industrieländern klagt über Sodbrennen, wobei die Prävalenz mit zunehmender Schwangerschaft – 20 % im 1. Trimenon, 40 % im 2., über 70 % im 3. Trimenon – stetig zunimmt. Ein Viertel der Schwangeren leidet täglich unter Sodbrennen unterschiedlicher Intensität (7, 19, 25, 38, 52). 4.2.1.1. Pathogenese Die Pathogenese der Refluxkrankheit ist multifaktoriell, zudem ist sie in der Früh- und Spätschwangerschaft unterschiedlich. Für die in der Frühgravidität auftretenden Beschwerden dürften nicht nur organische, sondern insbesondere auch psychische Komponenten gleichermaßen eine wesentliche Rolle spielen. Ein gesicherter Faktor ist die Schädigung des Plattenepithels beim Brechakt im Rahmen von Emesis oder Hyperemesis gravidarum. Weiterhin konnte gezeigt werden, daß bei noch normalem Ruhedruck des unteren Ösophagussphinkters bereits eine herabgesetzte Stimulierbarkeit des Sphinkters gegenüber hormonalen, physiologischen und pharmakologischen Reizen besteht. Offensichtlich geschieht dies bereits unter dem Einfluß der ansteigenden Progesteron- und Östrogenspiegel (25, 30, 52). Mit Fortschreiten der Schwangerschaft nimmt der Ruhedruck des Ösophagussphinkters, dem Hauptgaranten für einen intakten Verschlußmechanismus, kontinuierlich und signifikant ab, um sich postpartal innerhalb von 6 Wochen zu normalisieren (Abb. 4.2). Dies wird dem relaxierenden Effekt der Gestagene und Östrogene zugeschrieben.
Abb. 4.2 Druckänderungen im unteren Ösophagussphinkter (Mittelwert ± Standardabweichung) während der Schwangerschaft und im Wochenbett. Normbereich 12 – 30 mm Hg (52)
Abb. 4.3 Druckänderungen im unteren Ösophagussphinkter (Mittelwert ± Stan dardabweichung) unter der Einnahme von oralen Kontrazeptiva. Normbereich 12 – 30 mm Hg (51). Analog wurde eine Ruhedruckverminderung des Sphinkters unter kombinierter Gabe von Östrogenen und Gestagenen (orale Kontrazeptiva) gesehen, und selbst in der Lutealphase des Menstruationszyklus finden sich signifikant erniedrigte Druckwerte (Abb. 4.3 und Abb. 4.4). Besonders bei Schwangeren mit Sodbrennen vermag der untere Ösophagussphinkter die chronische intraabdominelle Druckerhöhung wie auch akute Drucksteigerungen nicht mehr mit einer adäquaten Tonuserhöhung zu beantworten (23, 25, 30, 51 – 53). Zur Schwächung des Verschlußmechanismus tragen auch Alterationen der den Sphinkter umgebenden anatomischen Strukturen bei (Tab. 4.1). Von besonderer Bedeutung scheint das Vorliegen einer axialen Hiatushernie zu sein. Bei der Hiatushernie fallen Antireflux-Mechanismen wie die intraabdominelle Lage des Sphinkters, der Hissche Winkel und die Zwerchfellzwinge aus, darüber hinaus wird die Clearance-Funktion des Ösophagus beeinträchtigt.
Abb. 4.4 Druckänderungen im unteren Ösophagussphinkter (Mittelwerte) während des Menstruationszyklus von 10 gesunden Frauen. Normbereich 12 – 30 mm Hg (53). Tab. 4.1 Schutzmechanismen der Ösophagusschleimhaut (in derReihenfolge der Bedeutung) und ihre Schwächung während der Schwangerschaft
Röntgenologische und manometrische Untersuchungen haben gezeigt, daß Schwangere nun im Vergleich zu gleichaltrigen Nicht-Schwangeren eindeutig häufiger eine axiale Hiatushernie aufweisen, die Inzidenz liegt zwischen 13 und 62 %. Besonders betroffen sind ältere Schwangere und Mehrgebärende sowie der Zeitraum der letzten Schwangerschaftsmonate (8, 19, 25). Der intraabdominelle Druckanstieg, die Verlagerung des Magens nach links oben unter die Zwerchfellkuppe sowie die hormonell bedingte Schwächung fast sämtlicher mechanischer Antirefluxmechanismen bedingen diese häufige Manifestation axialer Hiatushernien bei Schwangeren. Ebenfalls im manometrischen Untersuchungen konnte gezeigt werden, daß bei Schwangeren im Gegensatz zu nichtschwangeren Frauen der intragastrische Druck erhöht, der intraösophageale Druck aber erniedrigt ist. Diese gestörten Druckverhältnisse begünstigen gleichfalls bei Vorliegen eines inkompetenten Sphinkters den Reflux vom Mageninhalt in den Ösophagus (Abb. 4.5) (8, 23, 25, 30, 50). Zur Aggravation tragen sowohl die häufig vorliegende verzögerte Magenentleerung als auch ein pathologischer duodenogastraler Reflux infolge Pylorusinkompetenz bei. Normalerweise befördert der Ösophagus das refluierte Material mit Hilfe der Peristaltik in den Magen zurück. Diese Selbstreinigungsfunktion erleidet offenbar gleichfalls in der Schwangerschaft eine Einbuße durch eine gestörte Peristaltik im tubulären Ösophagus.
Abb. 4.5 Fundusdruck (a), maximaler Sphinkterdruck (b) und Ruhedruck (c) von gesunden Kontrollpersonen (C), Schwangeren ohne Sodbrennen (NH) und Schwangeren mit Sodbrennen (H) (23). Zusammenfassend ist somit die gerade in der Spätschwangerschaft gehäuft auftretende Refluxkrankheit mit dem Leitsymptom des Sodbrennens das Ergebnis einer komplexen Schwächung des gastroösophagealen Verschlußventils. Pathogenetisch sind dabei nicht nur eine Funktionsstörung des unteren Ösophagussphinkters, sondern auch Alterationen der ihn umgebenden anatomischen Strukturen wie auch Funktionsstörungen der angrenzenden Organe Ösophagus und Magen von Bedeutung. Für diese „Fehlregulierung“ sind wesentlich die weiblichen Sexualhormone verantwortlich zu machen, wobei dem Progesteron die führende Rolle zukommt. 4.2.1.2. Klinik Als Leitsymptom der Refluxkrankheit gilt das Sodbrennen, das wahrscheinlich durch die direkte Mukosairritation der Speiseröhre durch Säure ausgelöst wird. Es handelt sich um einen unangenehm heißen oder brennenden retrosternalen oder im Epigastrium lokalisierten Schmerz, der mit saurem Geschmack in den Rachen aufsteigen kann. Manchmal können chronischer Husten, Laryngitis, Asthma-ähnliche Symptome Hinweise auf einen nächtlichen pathologischen Reflux sein. Weitere Symptome der Refluxkrankheit sind Aufstoßen von Luft, Regurgitation von Mageninhalt, Singultus, Nausea und Erbrechen. Wie ausgeführt, setzen die Symptome bei einigen Schwangeren bereits in der Frühschwangerschaft ein, häufig mit einer Besserung während des 2. Trimenons. Bei den weitaus meisten beginnt das Sodbrennen zu Beginn des 2. oder erst im letzten Schwangerschaftsdrittel, um nicht selten bis zum Entbindungstermin an Häufigkeit und Schwere zuzunehmen. Die frühere Auffassung, dass sich die Beschwerden in den letzten 4 Wochen der Schwangerschaft mit dem Senken des Fundus uteri besserten, trifft nur selten zu. Die Symptome treten am häufigsten im Liegen, beim Bücken, Pressen und nach reichlicher Nahrungsaufnahme auf und können durch psychischen Stress, Süßigkeiten, Rauchen, Kaffee- oder Alkoholgenuß verstärkt werden. Fakultative Folge eines gehäuften Refluxes ist die Ösophagitis. Es wird angenommen, daß sich bei 1 – 2 % der Schwangeren eine erosive und ulzeröse Ösophagitis ausbildet. Systematische endoskopische Untersuchungen zu dieser Frage existieren bisher nicht. Bevorzugt betroffen sind ältere Mehrgebärende, wobei nicht nur der pathologische Reflux, sondern auch ein gehäuftes Erbrechen pathogenetisch von Bedeutung ist. Die Symptomatik der erosiven Ösophagitis unterscheidet sich nicht von der Refluxkrankheit ohne Ösophagitis. Selbst eine ausgeprägte Ösophagitis kann relativ symptomarm verlaufen (19, 25, 30). Blutungen aus Defekten treten besonders zum Schwangerschaftsende hin auf, sie stehen unter den Ursachen einer oberen Intestinalblutung in der Schwangerschaft an erster Stelle (Tab. 4.2). In der Regel sind die Blutungen leicht (cave: Fehldeutung der Blutungsanämie als Schwangerschaftsanämie), nur in Ausnahmefällen massiv (19, 25, 30). Tab. 4.2 Ursachen der oberen Intestinalblutung in der Schwangerschaft (in der Reihenfolge der Häufigkeit)
In Einzelfällen kann es komplizierend zur Ausbildung eines Ösophagusulkus und/oder einer peptischen Stenose kommen. Das Ösophagusulkus verursacht brennende Retrosternalschmerzen, die in Rücken und Nacken ausstrahlen und durch den Schluckakt verstärkt werden. Peptische Stenosen, am Übergang vom Zylinderepithel zum Plattenepithel entstehend, geben sich mit dem Leitsymptom der Dysphagie in der Regel erst nach der Entbindung zu erkennen. Sie können aber auch schon während der Schwangerschaft und so früh wie im 6. Monat zur Beobachtung kommen (Abb. 4.6) (25). Anamnestisch findet sich meist die Angabe einer Hyperemesis gravidarum, wahrscheinlich handelt es sich häufig aber auch um die Verschlimmerung einer präexistenten relativ symptomarmen Refluxerkrankung.
Abb. 4.6 Peptische Ösophagusstenose im unteren Drittel mit prästenotischer Erweiterung. Die Aufnahme erfolgte nach Beendigung der zweiten Schwangerschaft einer 25-jährigen Patientin (rezidivierendes Erbrechen seit dem 2. Monat; im 8. Monat bereits endoskopische Sicherung der Stenose 30 cm aboral). Tab. 4.3 Differentialdiagnose von Übelkeit und Erbrechen während der Schwangerschaft
Die Diagnose der Refluxkrankheit läßt sich in der Schwangerschaft aufgrund des Beschwerdebildes relativ sicher vermuten. Eine Sicherung der Diagnose durch Endoskopie oder pH-Metrie ist zunächst nicht erforderlich. Vielmehr muß eine Schwangere, die über Refluxsymptome klagt, unverzüglich adäquat behandelt werden. Ein Abweichen von diesem pragmatischen Vorgehen ist angezeigt, wenn nach 2 – 3-tägiger konsequenter Behandlung der Therapieeffekt ungenügend bleibt oder wenn Komplikationen (Hämatemesis, Melaena, Dysphagie etc.) auftreten oder vermutet werden. 4.2.1.3. Therapie Beim Auftreten von Refluxbeschwerden, falls sie nicht nur gelegentlich oder in milder Form auftreten, sollte eine konsequente konservative Therapie einsetzen. Zu den allgemeinen Maßnahmen gehört das Schlafen mit erhöhtem Oberkörper (Erhöhung des Kopfendes um 30° durch Unterschieben von Holzklötzen unter das Bett), das Tragen weiter, nicht beengender Kleider, das Vermeiden des Bückens sowie der Horizontallage nach dem Essen. Diätetisch ist eine eiweißreiche fettarme Nahrung zu bevorzugen, die in 5 – 6 kleinen Portionen über den Tag verteilt gegessen wird und wobei die letzte Mahlzeit spätestens 2 Stunden vor dem Zubettgehen eingenommen werden darf. Weiterhin sind alle Faktoren zu vermeiden, die den Sphinkter weiter schwächen oder die Refluxsymptomatik begünstigen (reichlicher Verzehr von süßen Kohlenhydraten, Nikotin, Alkohol, Karminativa, Kaffee, Anticholinergika, aber auch Streßsituationen) oder den intraabdominellen Druck noch erhöhen (Obstipation, große Mahlzeiten). Im Rahmen der Basistherapie sollten zusätzlich zu diesen allgemeinen Maßnahmen Antazida in normalen Dosen jeweils eine Stunde nach jeder Mahlzeit sowie bei Auftreten von Beschwerden gegeben werden. Zu bevorzugen sind Kombinationspräparate aus Aluminium-, Magnesium- und Kalziumsalzen mit hoher Neutralisationskapazität. Weiterhin können auch Filmbildner (Gaviscon) sowie auch Sucralfat (Ulcogant) empfohlen werden. Antazida sind keine inerten Substanzen, vielmehr lösen sie spezifische Reaktionen im Gastrointestinaltrakt und im Mineralhaushalt aus. Die meisten dieser Reaktionen sind Folgen einer systemischen Wirkung, abhängig von der jeweiligen chemischen Zusammensetzung des Antazidums wie auch von der verwendeten Dosierung. In der Regel ist in der Schwangerschaft jedoch eine risikofreie Therapie mit den oben genannten Präparaten möglich, ausgenommen Schwangere mit einer Niereninsuffizienz. Die häufigsten Nebenwirkungen der Antazida sind Stuhlunregelmäßigkeiten (Obstipation bei aluminiumhaltigen Antazida, Diarrhoen bei magnesiumhydroxidhaltigen Antazida) sowie Interaktionen mit anderen Substanzen. Einen guten therapeutischen Effekt, insbesondere bei begleitender Übelkeit, haben auch motilitätswirksame Substanzen wie Metoclopramid, Bromoprid und Domperidon. Diese Pharmaka supprimieren das Brechzentrum im Hirnstamm, erhöhen selektiv den Druck des unteren Ösophagussphinkters und steigern die gastrointestinale Motilität von Ösophagus, Magen und Dünndarm. Obwohl bei diesen Substanzen, von denen mit Metoclopramid die meisten Erfahrungen vorliegen, bisher weder im Tierversuch noch für den Menschen embryotoxische, teratogene und mutagene Wirkungen nachgewiesen werden konnten, empfiehlt es sich dennoch, sie im ersten Trimenon nur unter strengen Gesichtspunkten zu verabreichen. Dasselbe gilt für die Gabe von H2-Rezeptor-Antagonisten und von Protonenpumpenhemmern. Auch in der Schwangerschaft sind diese potenten Inhibitoren der Magensäuresekretion am wirksamsten. Da jedoch bisher nur begrenzte Erfahrungen in der Schwangerschaft vorliegen und keine systematischen Studien existieren, sollten diese Substanzen nur in schweren und sonst therapierefraktären Problemfällen verordnet werden. Alle Substanzen passieren die Plazenta und sind auch in Spuren in der Muttermilch nachzuweisen, jedoch haben sich embryotoxische oder teratogene Wirkungen in der Schwangerschaft bisher nicht erkennen lassen. Grundsätzlich sollten bei gegebener Indikation diejenigen Substanzen bevorzugt werden, die am längsten eingeführt sind und bei denen deshalb Nebenwirkungen am ehesten gesehen worden wären (z.B. Cimitidin, Ranitidin und Omeprazol) (11, 19, 25, 26, 30). Außerhalb der Schwangerschaft sind Protonenpumpenhemmer (PPI) Mittel der Wahl, da nur sie einen Anstieg des intraösophagealen pH über 4 über mindestens 16 Stunden als Voraussetzung für eine Abheilung der Läsionen garantieren. Entsprechend wurde die früher propagierte Step-up-Therapie, bei der mit weniger wirksamen Medikamenten beginnend die Säurehemmung stufenweise verstärkt wurde (Antazida, Prokinetika, Sucralfat, H2-Blocker, PPI), verlassen zugunsten der Step-down-Therapie. Hier beginnt die Therapie mit einer hohen Dosis von PPI. Dadurch werden Symptome rascher beseitigt und Läsionen schneller zur Abheilung gebracht als bei der umgekehrten Strategie. Anschließend muß die individuelle Erhaltungsdosis ermittelt werden. In der Schwangerschaft ist allerdings eine solche Vorgehensweise nicht erlaubt, hier hat nach wie vor das Step-up-Prinzip Gültigkeit. Die Refluxkrankheit in der Schwangerschaft, ob mit oder ohne Ösophagitis, läßt sich mit den oben beschriebenen konservativen Maßnahmen in fast allen Fällen gut beherrschen. Nur bei lebensbedrohenden Zwischenfällen (massive Blutung, Perforation, hochgradige Stenose) ist eine endoskopische oder operative Intervention zu erwägen. Nur in Einzelfällen kann in der Spätschwangerschaft bei lebensfähigem Kind bei Vorliegen heftigster Refluxbeschwerden trotz Therapie die Geburtseinleitung gerechtfertigt sein. Insgesamt beeinflußt die unkompliziert verlaufende Refluxkrankheit den Schwangerschaftsverlauf oder die kindliche Prognose nicht. Nach Beendigung der Schwangerschaft pflegen die Refluxbeschwerden mit dem Sistieren der hormonellen Schwächung der Antirefluxmechanismen und dem Wegfall der intraabdominellen Drucksteigerung in der Regel spontan zu verschwinden. Insgesamt ist die Langzeitprognose der Refluxkrankheit, die sich während der Schwangerschaft manifestiert, als günstig anzusehen. 4.2.2. Sonstige Ösophaguserkrankungen Auf einige Komplikationen von seiten der Speiseröhre wie Blutungen aus erosiven und ulzerösen Läsionen, Mallory-Weiss-Syndrom, peptische Ösophagusstenose, emetogene Ruptur des Ösophagus und Inkarzeration der Hiatushernie wurde oben bereits hingewiesen. Das Syndrom der portalen Hypertension und die Blutung aus Ösophagusvarizen werden in Kap. 1.2.8. und 1.2.9. besprochen. Tumoren, Infektionen, Divertikel, Verätzungen, primäre
Ösophagusmotilitätsstörungen wie diffuser
Ösophagusspasmus oder hyperkontraktiler Ösophagus, Multisystemerkrankungen
mit Beteiligung der glatten Muskulatur bzw. des autonomen Nervensystems
(z.B. Sklerodermie, Diabetes mellitus) spielen in der Schwangerschaft
keine besondere Rolle, so daß hier auf die entsprechende Fachliteratur
verwiesen werden kann. Leitsymptome einer jeden organischen und
funktionellen Speiseröhrenerkrankung sind Sodbrennen, Dysphagie
und Thoraxschmerzen, wobei diese Symptome isoliert oder auch kombiniert
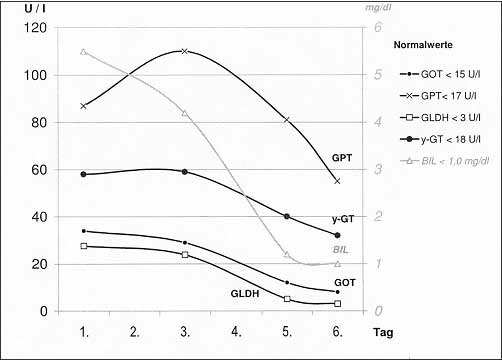
auftreten können. Eine ganze Reihe von Medikamenten können, wenn sie mit zu wenig Wasser eingenommen werden, im Ösophagus stecken bleiben und Schleimhautläsionen bis hin zu akuten Ulzera mit der Gefahr von Perforation und Striktur induzieren. Überwiegend handelt es sich um Antibiotika, aber auch nichtsteroidale Antiphlogistika, Kaliumchlorid, Eisensulfat, Ascorbinsäure, Theophyllin können zu diesen Schäden führen. Zur Verhütung der Pillenösophagitis sollten Tabletten in aufrechter Position mit mindestens 140 ml Wasser eingenommen werden. Medikamentös induzierte Ösophagusulzera heilen ohne spezielle Therapie innerhalb weniger Wochen ab. Die Achalasie ist eine primäre Motilitätsstörung des Ösophagus unklarer Ätiologie, die sich durch einen Verlust der geordneten Peristaltik in der tubulären Speiseröhre und eine Relaxationsstörung des unteren Ösophagussphinkters auszeichnet. Diese seltene Erkrankung kann in jedem Lebensalter auftreten mit einem Häufigkeitsgipfel zwischen dem 30. und 60. Lebensjahr. Beide Geschlechter sind gleich häufig betroffen. Leitsymptom und meistens auch Erstsymptom ist die Dysphagie bei festen, aber auch flüssigen Speisen, aktive und nachfolgend passive Regurgitation treten später hinzu. Hand in Hand mit der Dysphagie und der Regurgitation geht eine Gewichtsabnahme, die in kurzer Zeit durchaus stärkere Ausmaße annehmen und die insbesondere das Leben von Mutter und Kind gefährden kann. In wie außerhalb der Schwangerschaft können diese Beschwerden kontinuierlich, aber auch intermittierend vorhanden sein. Im Einzelfall ist daher nicht vorhersehbar, ob die Erkrankung in der Schwangerschaft relativ symptomlos verläuft oder ob es zur Zunahme der Symptomatik und zur Verschlechterung des mütterlichen Gesundheitszustandes kommt. Die Diagnose läßt sich auch in der Schwangerschaft mit Hilfe von Anamnese und Endoskopie, nur in Zweifelsfällen ergänzt durch Röntgenuntersuchungen und Manometrie relativ sicher stellen. In der Behandlung sollte auf medikamentöse Therapieversuche verzichtet werden. Die Therapie der Wahl stellt die pneumatische Dilatation dar. Aspiration und Pneumonie sind eine wichtige Komplikation der Regurgitation, die besonders unter der Geburt, vor allem bei schmerzlindernden und sedierenden Maßnahmen, gegeben ist. Es empfiehlt sich daher, bei Beginn der Wehentätigkeit den Ösophagus über einen dicken Magenschlauch zu entleeren (25). 4.2.3. Anhang: Nausea, Emesis und Hyperemesis gravidarum Übelkeit, Appetitstörungen und Erbrechen sind häufige Symptome in der Frühschwangerschaft mit einer Inzidenz der Nausea von 50 – 90 % bzw. der Emesis von 25 – 55 %. Alter (geringeres Risiko mit zunehmendem Alter), Übergewicht, Essstörungen, Allergien, erste Schwangerschaft, Zwillingsschwangerschaften, ökonomischer Status sowie demografische Faktoren beeinflussen die Inzidenz. In der Regel sind Nausea und Emesis selbstlimitierend. Nach einem Beginn gewöhnlich in der 6. Woche mit einem Maximum zwischen 10. und 16. Schwangerschaftswoche sistieren die Beschwerden vor der 20. Schwangerschaftswoche. Das leichte morgendliche Erbrechen (seltener ist eine kontinuierliche oder abendliche Symptomatik) in der Frühschwangerschaft bedarf keiner speziellen Therapie. Eine Ernährungsberatung und die Gabe von Vitamin B6 können hilfreich sein. Mütterliche und kindliche Prognose erfahren keine Beeinflussung. Bei 0,1 – 2 % der Schwangeren entwickelt sich jedoch das Krankheitsbild der Hyperemesis gravidarum, wobei die Grenzen zwischen Emesis und Hyperemesis gravidarum fließend sind. Die Hyperemesis ist durch persistierendes (mehr als fünfmaliges), nicht stillbares Erbrechen sowie Übelkeit während des gesamten Tages und der Nacht gekennzeichnet, unabhängig von der Nahrungsaufnahme. Im Gegensatz zur Emesis gilt die Hyperemesis als pathologisch und somit als therapiebedürftig. In den letzten Jahrzehnten hat aus noch nicht geklärten Gründen die Häufigkeit dieser Erkrankung deutlich abgenommen. Ein befriedigendes Erklärungsmodell der Ätiologie existiert bislang nicht. Man geht von einem multifaktoriellen Geschehen aus, die Beteiligung von hormonalen (erhöhte HCG-Konzentrationen, erhöhte Östrogen- und Progesteronspiegel, erniedrigte Motilinspiegel, primäre und sekundäre Nebennierenrindeninsuffizienz, gesteigerte Schilddrüsenfunktion), immunologischen und psychosozialen Faktoren wird ebenso diskutiert wie eine erhöhte bakterielle Besiedelungsquote des Magens mit Helicobacter pylori und Motilitätsstörungen des Magens. Im Rahmen des vielfachen Erbrechens kann sich ein klinisches Bild entwickeln, das durch Gewichtsabnahme (mehr als 5 %), Dehydratation, Störungen des Elektrolyt- und Säure-Basen-Haushalts sowie ein ausgeprägtes Krankheitsgefühl gekennzeichnet ist. Bei weiterem Fortschreiten entwickeln sich infolge abnehmender Vitamin-B-Spiegel Muskelschwäche und Polyneuropathie. Funktionelle Leberstörungen finden sich gewöhnlich nur bei schwereren Verläufen, die der Hospitalisierung bedürfen. Sie sind nur leichter Natur und normalisieren sich bei entsprechender Behandlung rasch. Das Bilirubin im Serum bleibt meist unter 4 mg/dl, wobei direktes und indirektes Bilirubin als Folge der Inanition erhöht sind. Die Aktivitäten der Transaminasen im Serum sind normal bis leicht erhöht, selten werden Werte bis 100 oder 200 U/l erreicht (Abb. 4.7).
Abb. 4.7 Verlauf des Bilirubins und der Enzymaktivitäten im Serum bei Hyperemesis gravidarum (22-jährige Patientin, 10. Woche, Erbrechen seit 1 Woche). Metabolische Alkalose, Hypokaliämie, Hypochloridämie, Exsikkose. Besserung sämtlicher Symptome unter parenteraler Ernährung und Substitution von Wasser und Elektrolyten sowie antiemetischer Therapie. Histologisch findet sich nur vereinzelt eine vorwiegend zentroazinäre Leberzellverfettung, was auf die Mangelernährung zurückzuführen ist. Differentialdiagnostisch sind hier ein mit Erbrechen einhergehendes Prodromalstadium einer akuten Virushepatitis sowie medikamentös-toxische Leberschäden abzugrenzen (s. Kap. 1.2.1.1.). Als mögliche Komplikationen bei unzureichender Therapie treten schließlich zentrale Symptome wie Temperaturanstieg, Somnolenz, Delir auf und als Extremfolge die Wernicke-Enzephalopathie. Die Ausbildung einer Refluxkrankheit der Speiseröhre eventuell mit erosiver oder ulzeröser Ösophagitis, das Mallory-Weiss-Syndrom (Blutungen aus Schleimhauteinrissen des Ösophagus), die Ruptur des Ösophagus (Boerhaave-Syndrom), die Aspiration von Mageninhalt bei bewusstseinsgetrübten Schwangeren, die Bildung von Zahnschmelzerosionen durch das Magensekret, insbesondere die Salzsäure, können weitere Folgen des rezidivierenden Erbrechens sein. Die Behandlung der Hyperemesis gravidarum durch die Kombination somatischer und psychosomatischer Maßnahmen führt fast immer zur Besserung oder zur Behebung der Symptomatik. Des Weiteren ist eine antiemetische Therapie erforderlich. Mittel der Wahl als Antiemetika sind H1-Antihistaminika (z. B. Dimenhydrinat, Meclozin). Bei schweren Formen der Hyperemesis eignen sich auch Phenothiazine (z. B. Chlorpromazin, Promethazin, Triflupromazin). Motilitätsregulatoren weisen neben einem unterschiedlich starken zentralen antiemetischen Effekt prokinetische Wirkungen auf den oberen Gastrointestinaltrakt auf. Sie finden daher – wie oben beschrieben – bevorzugt als Antiemetikum im Rahmen der gastroösophagealen Refluxkrankheit im 2. und 3. Trimenon Anwendung. In der Frühschwangerschaft sind dagegen die Erfahrungen begrenzt. Am besten untersucht und damit Mittel der Wahl ist das in die Gruppe der substituierten Benzamide gehörende Metroclopramid. Bei den 5-HT3-Rezeptorantagonisten (z. B. Ondansetron) handelt es sich um hochselektive Substanzen, die eine kompetitive Blockade peripherer und zentraler 5-HT3-Rezeptoren bewirken. Obwohl für die Hyperemesis gravidarum einzelne kasuistische positive Befunde existieren, sollten im Augenblick jedoch diese Antagonisten (unter Bevorzugung des Ondansetron als der ältesten 1991 in Deutschland eingeführten Substanz) nur bei klinisch schweren Verläufen und bei Versagen der oben genannten bisher besser untersuchten Antiemetika eingesetzt werden. In derartigen Fällen ist auch der Versuch einer kurzzeitigen Gabe von Methylprednisolon gerechtfertigt. Dagegen empfiehlt sich Zurückhaltung trotz Einzelfallberichten über die erfolgreiche Anwendung von Thyreostatika oder Protonenpumpenhemmern (z. B. Omeprazol) beim therapieresistenten Schwangerschaftserbrechen aufgrund unzureichender Erfahrungen (26). Differentialdiagnostisch müssen bei persistierendem Erbrechen grundsätzlich neben der Hyperemesis gravidarum auch andere gastrointestinale wie extraintestinale Ursachen ausgeschlossen werden. Gerade in den späteren Phasen der Schwangerschaft sind Übelkeit und Erbrechen häufig die Vorboten zahlreicher anderer, von der Schwangerschaft abhängiger oder unabhängiger Erkrankungen (Tab. 4.3).
Von den Erkrankungen des Magens sollen hier nur jene besprochen werden, deren klinisches Bild im Verlauf der Schwangerschaft eine Änderung erfahren kann. Das trifft insbesondere für die Ulkuskrankheit und nur in geringem Maße für das Magenkarzinom zu. Damit wird natürlich nicht ausgeschlossen, dass auch andere Magenerkrankungen mit einer Schwangerschaft zusammentreffen können. So wurden einzelne Fälle von akuter Magenatonie, Volvulus und spontaner Ruptur des Magens beobachtet und ebenso wurde über komplikationslose Schwangerschaftsverläufe nach Magenresektionen oder Gastrektomie berichtet. 4.3.1. Physiologische Veränderungen Während der Schwangerschaft kommt es zunehmend zur Verdrängung des Magens nach links oben unter das Zwerchfell und zur Drehung um seine Achse um 45°. Der vergrößerte Uterus erhöht den intraabdominellen Druck und komprimiert den Magen, so daß es zum intragastralen Druckanstieg kommen kann. Minderung von Tonus und Motilität sind die Folge einer hormonell bedingten generellen Relaxation der glatten Muskulatur. Allerdings erfährt die Magenentleerung durch diese Veränderungen keine Verzögerung, wie früher anhand von röntgenologischen Untersuchungen angenommen wurde. Auch in der Lutealphase des normalen Zyklus findet sich keine Änderung der Magenentleerung. Eine solche findet sich jedoch häufig bei Schwangeren mit Sodbrennen und zählt damit zu den pathogenetischen Mechanismen der Refluxerkrankung. Eine verzögerte Magenentleerung besteht regelmäßig unter der Geburt, wobei ursächlich eine stressinduzierte Hemmung von Tonus und Motilität, eventuell ein zusätzlicher Einfluss von Analgetika und Narkotika diskutiert werden. Dieser Befund erklärt zum Teil das erhöhte Aspirationsrisiko von flüssigem Mageninhalt unter der Geburt (Mendelson-Syndrom). Seit über 60 Jahren ist das Verhalten der Magensekretion während Zyklus, Schwangerschaft und Laktation sowie nach exogener Zufuhr von Sexualhormonen Gegenstand von Studien an verschiedenen Tierspezies unter den unterschiedlichsten Bedingungen wie auch beim Menschen. Die am Tier erhobenen Befunde divergieren als Hinweis auf speziesbedingte Unterschiede deutlich und können nicht auf den Menschen übertragen werden. Aber auch bei Schwangeren ergab die Überprüfung der Magensekretion mit unterschiedlicher Methodik bisher widersprüchliche Ergebnisse: Einerseits fand sich keine Änderung der Säure- und Pepsinsekretion, andererseits wurde eine Sekretionsminderung beobachtet. Als mögliche Ursachen für eine herabgesetzte Säuresekretion in der Schwangerschaft werden verschiedene Faktoren diskutiert wie die erhöhten Spiegel der weiblichen Sexualhormone, eine Verminderung der Gastrin-Spiegel, eine vermehrte Bildung von EGF (epidermal growth factor) sowie ein Anstieg der Plasmaspiegel der in der Plazenta synthetisierten Histaminase. Letztere könnte eine gesteigerte Metabolisierung des mütterlichen Histamins zur Folge haben. Den weiblichen Sexualhormonen wird darüber hinaus eine Stimulierung der Schleimproduktion der Magenschleimhaut zugeschrieben. Es gibt wenige Hinweise, daß sich im letzten Schwangerschaftsdrittel die Säuresekretion wieder normalisiert, ja sogar während der Laktationsphase erhöht sein kann. Analog erreichen auch die Pepsinspiegel im Serum in diesem Zeitraum die Werte wie bei Nichtschwangeren und ebenso steigt der Gastrin-Spiegel im 3. Trimenon bis zu einem Peak kurz nach der Entbindung an. Da sich jedoch auch hohe Gastrin-Spiegel im Nabelschnurblut finden, könnte fetales Gastrin, in den mütterlichen Organismus übertretend, zu dieser Erhöhung beitragen. Als weitere Ursachen für die Normalisierung oder sogar Erhöhung der Säuresekretion in der fortgeschrittenen Schwangerschaft bzw. im Wochenbett ließen sich eine Histaminzunahme durch eine fetale Histaminsekretion bzw. eine erhöhte Kalziumresorption während der Laktation anführen. Tierexperimentell fanden sich zumindest derartige Hinweise. Die Sekretion des Intrinsic-Faktors im Magen scheint während der Schwangerschaft ungestört zu sein, was sich aus einer normalen Resorption des Vitamin B12-Intrinsic-Faktor-Komplex im unteren Ileum schließen läßt (14, 19, 25). 4.3.2. Ulkuskrankheit Das peptische Ulkus des Magens und des Duodenums ist ein umschriebener Substanzdefekt, der die Muscularis mucosae durchbricht. Im Gegensatz dazu sind akute Erosionen auf die Mukosa beschränkt. Nach einer Häufung zu Beginn des 20. Jahrhunderts nimmt die Ulkuskrankheit seit den 60er Jahren wieder an Häufigkeit ab. Etwa jeder 10. Erwachsene entwickelt im Laufe seines Lebens ein Magen- oder Duodenalgeschwür. Das Zwölffingerdarmgeschwür ist mit einer Prävalenz von etwa 1,4 % häufiger als das Magengeschwür mit 0,3 %. Männer und Frauen sind beim Magengeschwür gleichermaßen betroffen, das Alter liegt meist zwischen 50 – 60 Jahren. Dagegen sind beim Ulcus duodeni die Patienten bis zu 20 Jahre jünger und Männer sind häufiger als Frauen betroffen. 4.3.2.1. Pathogenese Die Ulkuspathogenese ist multifaktoriell, von Bedeutung ist ein gestörtes Gleichgewicht zwischen defensiven (Bicarbonat-Sekretion, Schleimproduktion, Prostaglandin-Synthese, epitheliale Regeneration, ungestörte Durchblutung) und aggressiven Faktoren (Helicobacter pylori-Infektion, Salzsäure etc.). Die wichtigsten Faktoren in der Pathogenese sind die gastrale Infektion mit Helicobacter pylori und die Einnahme von nichtsteroidalen Antiphlogistika. Die Magensäure spielt eine zentrale Rolle in der Zerstörung der Schleimhaut. Die Prävalenz peptischer Ulzera, speziell des Duodenalulkus, ist nicht nur bei Frauen zur Zeit der Geschlechtsreife niedriger als bei Männern, sondern es ist auch weithin akzeptiert, dass während der Schwangerschaft die Prävalenz einer Ulkuserkrankung erniedrigt ist. Dies basiert auf Fallberichten, retrospektiven klinischen Serien und auf mehreren epidemiologischen Studien, aber auch auf einigen wenigen endoskopischen Studien, die einen Rückgang der peptischen Ulkuskrankheit und eine Zunahme der gastroösophagealen Refluxkrankheit belegen (14, 19, 25, 32). Die Faktoren, die im Einzelnen die Aktivität des Ulkusleidens in der Gravidität hemmen, sind noch nicht ausreichend bekannt. Die oben beschriebenen Befunde einer Hemmung der Säuresekretion und/oder einer Steigerung der Mukussekretion sind widersprüchlich, so daß diese Effekte allein nicht zur Erklärung ausreichen. Das Vermeiden ulzerogener Noxen wie Nikotin, Alkohol und Medikamente, aber auch ein verminderter psychologischer Streß, vermehrte körperliche Ruhe und eine ausgewogenere Kost während der Schwangerschaft werden als weitere protektive Faktoren diskutiert. Welche Bedeutung eine gastrale Infektion mit Helicobacter pylori in der Pathogenese peptischer Läsionen bei Schwangeren hat, ist nicht bekannt. Fast immer ist eine derartige Infektion mit einer chronischen Gastritis vergesellschaftet, allerdings entwickeln nur 10 – 15 % der infizierten Individuen eine peptische Ulkuskrankheit. Die Infektion mit Helicobacter pylori ist zusammen mit der Karies die weltweit häufigste chronische Infektion des Menschen. Die Prävalenz zeigt erhebliche regionale Unterschiede und hängt in hohem Maße von den sozioökonomischen Bedingungen ab. Daher finden sich Durchseuchungsraten in den Entwicklungsländern zum Teil von über 90 % bereits im Kindesalter. In den westlichen Industriestaaten ist die Seroprävalenz altersabhängig, 20 – 30 % der 20-jährigen und 50 –60% der über 50-jährigen sind infiziert. Vergleichbare Infektionsraten finden sich auch bei Schwangeren in Australien und Westeuropa mit durchschnittlich 20 bzw. 23 %. In einer belgischen Studie betrug die Prävalenz bei Schwangeren zwischen 26 und 30 Jahren etwa 20 %, bei Schwangeren zwischen 36 und 40 Jahren 31 %. Ähnliche Raten fanden sich bei der vergleichbaren männlichen Bevölkerung. Die Seroprävalenz scheint durch eine Schwangerschaft nicht beeinflußt zu werden. Obwohl Männer häufiger als Frauen ein peptisches Ulkus entwickeln, sind sie, wie epidemiologische Studien zeigen, nicht häufiger infiziert als Frauen. Der Übertragungsmodus ist bislang unklar. Der Nachweis von Helicobacter pylori im Trinkwasser weist auf einen fäkal-oralen Übertragungsweg hin, der Nachweis in Zahnplaques auf den oral-oralen Weg. Innerhalb von Familien sind sowohl horizontale als auch vertikale Übertragungswege möglich, wobei die Kinder im Zentrum der Infektionskette stehen. Die Produktion von Virulenzfaktoren erlaubt es den Helicobacter pylori-Stämmen die Magenschleimhaut zu kolonisieren und eine Gastritis zu induzieren, wobei gleichzeitig die Abwehrmechanismen des Wirts umgangen werden. Der histologische Nachweis einer chronisch-aktiven Gastritis ist der zelluläre Ausdruck der Immunantwort. Ein Mechanismus, der das Überleben des Feten im mütterlichen Organismus erklärt, ist die Entwicklung einer immunologischen Toleranz der Mutter gegenüber dem werdenden Kind. Um diese Toleranz zu gewährleisten, sind Schwangere wie auch der Fetus in der Lage, Immunreaktionen zu verhindern oder zu modulieren. Den weiblichen Geschlechtshormonen kommt dabei eine gewichtige Rolle als Immunmodulatoren zu. Eine attraktive, bisher aber nicht untersuchte Hypothese ist, daß im Rahmen der verschiedenen Immunreaktionen, die das Überleben des Embryos ermöglichen, es zu einer Suppression der Helicobacter pylori- Infektion kommen kann. Dies wäre dann ein weiterer transienter protektiver Mechanismus (9, 14, 16, 43). 4.3.2.2. Klinik Wie ausgeführt, ist auf der Basis klinischer Erfahrungen seit langem bekannt, daß die Gravidität keinen Risikofaktor darstellt, sondern vielmehr günstige Wirkungen auf die Ulkuskrankheit hat. Vorbestehende Ulzera werden symptomlos und heilen ab, neu entstehende werden nur sehr selten beobachtet und die Inzidenz an Komplikationen wird geringer. Gegen Ende der Schwangerschaft schwindet allerdings dieser protektive Effekt: Ulkusbeschwerden, die nicht vollständig abgeklungen waren, verstärken sich im letzten Trimenon, insbesondere kurz vor oder nach der Entbindung. Die günstige Wirkung auf die Ulkuskrankheit endet mit der Geburt, innerhalb von 2 Jahren post partum ist bei der überwiegenden Zahl der Ulkuspatientinnen wieder mit einem Rezidiv zu rechnen (14, 19, 25, 32). Allerdings bietet die Schwangerschaft keinen absoluten Schutz vor dem Auftreten einer peptischen Läsion. Das gilt sowohl für die chronische Ulkuskrankheit als auch insbesondere für akute Stressläsionen, die zu jedem Zeitpunkt der Schwangerschaft bei schweren Erkrankungen (z.B. Sepsis, Präeklampsie, akute Schwangerschaftsfettleber) auftreten können. Häufig kommt es ohne lokale Vorbeschwerden zu akuten Blutungen aus derartigen akuten Erosionen und akuten Ulzera, aber auch Perforationen können sich entwickeln (19, 25). Für einen möglichen protektiven Effekt der Schwangerschaft könnten auch Beobachtungen an allerdings nur zwei Graviden mit Zollinger-Ellison-Syndrom (Gastrin-produzierende Tumoren mit multiplen Ulzera) sprechen, bei denen die Erkrankung wenige Tage nach der Entbindung exazerbierte (39). Die Symptomatologie des Ulkusleidens entspricht der bei Nichtschwangeren. Aber auch hier dürften Ulzera mit uncharakteristischen oder sogar ohne Beschwerden einhergehen, so daß sich Diagnose und Differentialdiagnose des Ulkus gerade in der Schwangerschaft, in der epigastrische Beschwerden und Schmerzen auch ohne Magenerkrankung nicht gerade selten sind, schwierig gestalten. Dyspeptische Beschwerden werden meist als Emesis oder Hyperemesis gravidarum, als Reizmagen-Reizdarm-Syndrom, als gastroösophageale Refluxkrankheit oder auch bei nicht erkannter Blutung als Schwangerschaftsanämie interpretiert, ein Ulkus jedoch nicht in Betracht gezogen. Bei persistierenden dyspeptischen Beschwerden, Übelkeit, Erbrechen (zur Differentialdiagnose der Hämatemesis s. Tab. 4.2), Rückenschmerzen oder ausgeprägter Anämie kann die zeitgerechte Diagnose eines peptischen Ulkus zu jedem Zeitpunkt der Schwangerschaft komplikationslos durch die Endoskopie auch ohne Prämedikation und Sedierung durchgeführt werden. Zahlreiche Studien belegen, daß endoskopische Verfahren für Mutter und Feten ein sicheres Vorgehen sind (12). Differentialdiagnostisch zu erwägende Erkrankungen der Nachbarorgane wie Cholelithiasis und akute Pankreatitis sind durch Labor und sonographische Untersuchungen auszuschließen. Röntgenuntersuchungen sind in der Regel verzichtbar. Besonders schwierig ist das Erkennen von Blutungen, Perforationen und Penetrationen als Komplikationen der peptischen Läsionen kurz vor dem Ende der Schwangerschaft, unter der Geburt und im Wochenbett. Dies ist durch die bis dahin oft leere Anamnese, durch die plötzlich einsetzende Symptomatik bedingt, die durch die topographisch-anatomischen Besonderheiten in der Schwangerschaft Änderungen erfahren und die unter der Geburt durch die Wehentätigkeit maskiert werden kann. Entsprechend hoch ist die Zahl der Fehldiagnosen wie: - Plazenta praevia, und damit auch die Zahl der mütterlichen und kindlichen Todesfälle (14, 19, 25). Beim Auftreten von Komplikationen, eventuell im Rahmen von Zweiterkrankungen, hängt somit die Prognose für Mutter und Kind entscheidend vom raschen Erkennen und der adäquaten Behandlung ab. In keinem Fall stellt aber die Ulkuskrankheit eine Indikation zur Abruptio dar. In den letzten Jahren finden sich aus verschiedenen Regionen mehrere Hinweise auf einen möglichen Einfluß einer Helicobacter pylori-Infektion auf das körperliche Wachstum im Kindesalter. Es wird über eine Wachstumsverzögerung bei infizierten Kindern im Alter von bis zu 16 Jahren berichtet. Möglicherweise ist dieses Problem in Entwicklungsländern von größerer Bedeutung, da hier mit hohem Durchseuchungsgrad die Infektion schon sehr früh im Kleinkindesalter erworben wird, während dies in den Industrienationen später stattfindet (43). Pathogenetisch könnten sowohl verschiedene Virulenzfaktoren der Helicobacter pylori-Stämme als auch wirtspezifische Faktoren eine Rolle spielen. Darüber hinaus könnte die chronische Helicobacter pylori-Gastritis über eine Hypo- und Achlorhydrie eine bakterielle Überbesiedlung des Dünndarms begünstigen, was zum klinischen Bild der Malassimilation führen kann. Eine Anämie, chronische Durchfälle und Gewichtsverlust bewirken letztlich eine Wachstumsverzögerung. Aufgrund dieses möglichen Zusammenhangs zwischen Infektion einerseits und körperlicher Entwicklung andererseits stellt sich die Frage, ob ebenfalls eine Assoziation zwischen Helicobacter pylori-Infektion und intrauteriner Wachstumsretardierung besteht, zumal die verschiedenen bakteriellen oder viralen Infektionen zu den Ursachen einer derartigen Komplikation zählen. Die erste prospektive Studie zu diesem Thema aus Australien scheint diesen Zusammenhang zu bestätigen. Eine intrauterine Wachstumsverzögerung war häufiger bei Helicobacter pylori-seropositiven Schwangeren als bei seronegativen: 13,5 % versus 6 %. Sowohl diese Helicobacter pylori-Seropositivität als auch die mütterliche Größe und Nikotinabusus waren unabhängige Risikofaktoren für eine intrauterine Wachstumsretardierung. Die Autoren vermuten als pathogenetische Mechanismen eine mangelhafte Ernährung der Schwangeren durch vermehrtes Auftreten von dyspeptischen Beschwerden, Übelkeit oder Erbrechen infolge der Helicobacter pylori-Infektion oder auch eine bakteriell induzierte Schädigung der plazentaren Gefäße (16). 4.3.2.3. Therapie Beim Nachweis eines Ulkus in der Schwangerschaft ist es das Ziel, die Beschwerden zu beseitigen, die Heilung zu beschleunigen und damit Komplikationen zu verhindern. Die Behandlung des unkomplizierten Ulkus besteht aus Allgemeinmaßnahmen und einer medikamentösen Therapie. Zu den allgemeinen Maßnahmen zählen das Aufgeben des Zigarettenrauchens, die Vermeidung von Säurelockern (Verzicht auf: Alkohol, Bohnenkaffee, starker Tee) und das Absetzen von Medikamenten mit schleimhautschädigender Wirkung (nichtsteroidale Antiphlogistika). Eine spezifische Ulkusdiät gibt es nicht, vielmehr ist unter Berücksichtigung von Nahrungsmittelunverträglichkeiten eine gemischte, vollwertige, leichtverdauliche Kost anzubieten. Gelegentlich wird es als angenehm empfunden, die Gesamtkalorienmenge auf 6 – 8 kleine Mahlzeiten über den Tag zu verteilen. Eine stationäre Behandlung ist in der Regel nur beim Auftreten von Komplikationen gerechtfertigt. Es wird empfohlen, in der Laktationsphase bei Ulkusanamnese oder bestehendem Ulkus vom Stillen des Kindes Abstand zu nehmen, um keine Aktivierung der Erkrankung zu riskieren. Zur Pharmakotherapie werden wie bei der gastroösophagealen Refluxkrankheit im Wesentlichen säurehemmende Medikamente eingesetzt. Antazida in der üblichen Dosierung für die Dauer von 4 – 6 Wochen sind Therapeutika der 1. Wahl. Eine Alternative stellt das Sucralfat dar. Die Gabe von H2-Rezeptorantagonisten und Protonenpumpenhemmern sollte auch hier auf Fälle mit kompliziertem und/oder Antazida-refraktärem Ulkus beschränkt bleiben. Dies gilt insbesondere beim Vorliegen eines Zollinger-Ellison-Syndroms, hier ist eine Dauermedikation mit Protonenpumpenblockern während der gesamten Schwangerschaft indiziert (14, 17, 22). Prostaglandin-Derivate (Misoprostol) werden außerhalb der Schwangerschaft zur Therapie bei medikamentös-toxischen Magenschleimhautschäden bzw. zu deren Prophylaxe eingesetzt. In der Schwangerschaft sind diese Substanzen jedoch kontraindiziert, da sie Kontraktionen des Uterus bzw. Aborte hervorrufen können (14, 19, 25, 26). Bei Nachweis von Helicobacter pylori sollte die Eradikationsbehandlung insbesondere in den westlichen Industrienationen mit hohem Lebens- und Hygienestandard erst nach Beendigung der Schwangerschaft durchgeführt werden, zumal die Monotherapie mit einem Säureblocker ausreichend effektiv ist. Die heute empfohlene Eradikationstherapie besteht aus einem Säurehemmer und zwei Antibiotika verabreicht für die Dauer von einer Woche. Aufgrund fehlender Erfahrungen mit den verschiedenen Kombinationen zur Eradikationstherapie in den ersten 4 Monaten der Schwangerschaft sind teratogene Nebenwirkungen (z.B. Claritromycin) nicht sicher auszuschließen. Bei der oben beschriebenen möglichen Assoziation von Helicobacter pylori-Infektion und intrauteriner Wachstumsverzögerung, die in weiteren Studien gesichert werden muß, stellt sich vielmehr die Frage, ob bei Frauen im gebärfähigen Alter eine Helicobacter pylori-Infektion erfaßt werden sollte, um eine Eradikationstherapie noch vor dem Eintreten einer Schwangerschaft einzuleiten. Bei einer intestinalen Blutung sollte nach endoskopischer Sicherung der Blutungsquelle immer der Versuch der endoskopischen Blutstillung (Unterspritzung mit verdünnter Adrenalinlösung und/oder Fibrinkleber) gemacht werden. Die endoskopisch unstillbare Blutung und das perforierte Ulkus, bereits der dringende Verdacht auf ein solches Geschehen, sind Indikationen für eine sofortige chirurgische Intervention. 4.3.3. Magenkarzinom Unter den malignen Magentumoren haben die Adenokarzinome die größte klinische Relevanz. Selten sind maligne Lymphome, Sarkome und Magenmetastasen. Beim Magenfrühkarzinom ist die Ausdehnung auf die Mukosa und Submukosa beschränkt, beim fortgeschrittenen Magenkarzinom infiltriert der Tumor die Muscularis propria. Die Pathogenese ist multifaktoriell. Genetische und diätetische Faktoren, aber auch die Infektion mit Helicobacter pylori als unabhängigem Risikofaktor spielen eine Rolle. Die Inzidenz zeigt beträchtliche regionale Unterschiede, wobei weltweit die Inzidenz- und Sterberaten in den letzten Jahrzehnten deutlich zurückgegangen sind. Wie in den USA dürfte die Inzidenzrate bei uns derzeit bei etwa 10 Fällen pro 100.000 Menschen liegen. Männer erkranken etwa doppelt so häufig wie Frauen im höheren Lebensalter (über 60 Jahre), der Anteil der unter 40-jährigen beträgt weniger als 5 %. Diese Daten machen verständlich, daß ein Zusammentreffen von Magenkarzinom und Schwangerschaft äußerst selten ist. In der Literatur existieren einige hundert Fälle einer derartigen Kombination, die teilweise jedoch nur kursorisch aufgeführt werden (14, 25, 36, 49). Da es keine zuverlässigen Früh- und Warnsymptome des Magenkarzinoms gibt, wird die überwiegende Zahl erst in fortgeschritteneren Stadien diagnostisch erfaßt. Diese späte Diagnosestellung kann in der Schwangerschaft leicht eine weitere Verzögerung erfahren, da die beim primär fortgeschrittenen wie auch beim Magenfrühkarzinom fast immer vorhandenen Oberbauchbeschwerden unterschiedlicher Art und Ausmaßes (Schmerzen, Inappetenz, Erbrechen u.a.) als „Schwangerschaftsbeschwerden“ fehlgedeutet werden. Es kommt hinzu, daß die Möglichkeit eines Magenkarzinoms in der Schwangerschaft überhaupt zu selten in Betracht gezogen wird. Bei einer eigenen Beobachtung einer 40-jährigen Patientin kam es in der 5. Schwangerschaft nach unauffälligem Verlauf in der 38. Woche zu einer akuten oberen intestinalen Blutung, als deren Ursache erst durch die sofort durchgeführte Endoskopie unerwartet ein ausgedehntes Magenkarzinom gefunden wurde (25). In den bisherigen kasuistischen Mitteilungen wurde die Diagnose überwiegend in der 2. Schwangerschaftshälfte und nach der Geburt gestellt, nur selten war das Karzinom bereits vor der Schwangerschaft nachgewiesen worden. Die Prognose des Magenkarzinoms hängt nicht von der Phase der Schwangerschaft ab, in der das Karzinom festgestellt und einer Therapie zugeleitet wird, sondern Therapie- unabhängig spielen verschiedene andere Faktoren eine Rolle, wobei das Verhalten des Tumors (Tumorsitz, Tumorausbreitung, histologische Klassifikation) und dessen Trägers bzw. Interaktionen zwischen beiden im Vordergrund stehen. Den Haupteinfluß hat dabei die Tumorausbreitung, d.h. lokale Infiltration des Tumors und metastatischer Lymphknotenbefall bzw. Fernmetastasierung. Auch in der Schwangerschaft ist das chirurgische Vorgehen als Primärtherapie beim Magenkarzinom anzusehen, da sich Chemotherapien verbieten. Da eine Abruptio keinen günstigen Einfluß auf den Krankheitsverlauf erkennen läßt, sollte bei Ausschöpfung der chirurgischen Therapiemöglichkeiten die Schwangerschaft belassen bzw. bei reifem Kind die Geburtseinleitung oder die Schnittentbindung mit der Magenoperation kombiniert werden (14, 25, 36, 49). Bisher ist mütterliche und kindliche Prognose als schlecht einzustufen, bedingt durch die verzögerte Diagnostik und möglicherweise durch ein aggressiveres Tumorverhalten. Bei 61 Schwangeren in Japan betrug die 3-Jahres-Überlebensrate nur 21 % (49). Eine Verbesserung dieser schlechten Langzeitergebnisse kann nur von einer früheren Diagnose erwartet werden. Aus diesem Grunde sollte jede Schwangere mit länger als 14 Tagen persistierenden Oberbauchbeschwerden oder bei unzureichendem Therapieerfolg der endoskopischen Untersuchung zugeführt werden. Jede umschriebene Schleimhautveränderung, speziell jedes Ulkus muss biopsiert und histologisch untersucht werden. Da bis zu 5 % aller makroskopisch als gutartig klassifizierten Ulzera Karzinome, meist sogar Frühkarzinome sind, ist die gründliche bioptische Untersuchung jeder Läsion absolut erforderlich. 4.4.1. Enterale Ernährung bei Malnutrition Wie die bisher wenigen Untersuchungen beim Tier und Menschen zeigen, erfahren Struktur und Funktion des Darmes während der normalen Schwangerschaft keine wesentlichen Veränderungen, so daß dem Feten stets sämtliche notwendigen Aufbaustoffe zur Verfügung stehen. Im Bedarfsfall kann es sogar zur Steigerung der Resorptionskapazität kommen. Die duodenale Resorption von Kalzium ist während der Schwangerschaft und der Stillzeit, die von Eisen in der Spätschwangerschaft erhöht, möglicherweise als Folge einer Hypertrophie der Zotten. Voraussetzung für einen ungestörten Schwangerschaftsverlauf und eine normale Entwicklung des Feten ist allerdings eine qualitativ und quantitativ ausgewogene Kost, die den steigenden Kalorienbedarf in der Schwangerschaft deckt. Besteht bei einer Schwangeren eine Störung der oralen Nahrungsaufnahme aus den verschiedensten Gründen, ist sie von einer Mangelernährung bedroht, die u. U. die klinische Ernährungstherapie erforderlich macht. Hierbei ist die Ernährungstherapie sowohl enteral über Sondensysteme als auch parenteral über zentral- oder periphervenöse Katheter möglich. Eine kurzfristige derartige Ernährung bietet in der Schwangerschaft keine besonderen Probleme. Anders stellt sich die Situation bei Schwangeren dar, die bei unterschiedlichen Grunderkrankungen langfristig exklusiv oder ergänzend zur Prävention oder Therapie einer Malnutrition ernährt werden müssen. Beide Formen der Ernährung sind auch in dieser Situation möglich, jedoch sollte der enteralen Ernährung als der physiologischeren Form bei funktionstüchtigem Magen-Darm-Trakt grundsätzlich der Vorzug gegeben werden. Erfolgt die Ernährung über 2 – 4 Wochen bis zu mehreren Monaten und Jahren, hat heute an Stelle der transnasalen gastralen oder jejunalen Sonden die Methodik der perkutanen endoskopischen Gastrostomie (PEG) eine weite Verbreitung gefunden. Bei Problemen der gastralen Nahrungsmittelapplikation kann der Einsatz einer PEG mit jejunaler Sondenlage (JET-PEG) hilfreich sein (Abb. 4.8). Die enterale Langzeiternährung von Schwangeren mittels Sonde oder PEG wurde bisher nur in wenigen Fällen mitgeteilt. So wurde die erfolgreiche enterale Ernährung über eine PEG bei Patientinnen mit Hyperemesis gravidarum, Anorexia nervosa, chronisch-intestinaler Pseudoobstruktion und Malnutrition bei ösophagealer Atresie beschrieben. Von den bisher berichteten 7 Fällen mit einer enteralen Ernährung komatöser Schwangerer überlebten in nur 4 Fällen sowohl Mutter als auch Kind.
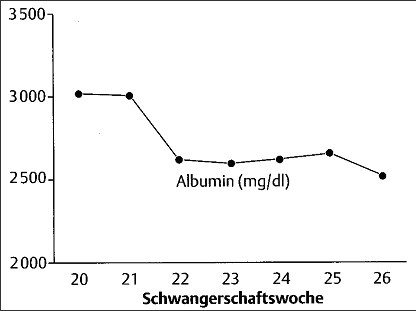
Abb. 4.8 Sonden zur parenteralen Ernährung. PEG = perkutane endoskopische Gastrostomie, JET-PEG = PEG mit jejunaler Sondenlage, EPJ = endoskopische perkutane Jejunostomie, FKJ = Feinnadelkatheterjejunostomie. Eine eigene Beobachtung einer Schwangeren mit apallischem Syndrom, bei der erstmals eine JET-PEG erfolgreich zum Einsatz kam und ein Monitoring durch wiederholte Bioelektrische Impedanz- Analysen (BIA) zur Steuerung der enteralen Ernährung erfolgte, sei hier beispielhaft dargestellt. Die 41-jährige Mutter von 5 Kindern wurde in der 8. Schwangerschaftswoche infolge eines linksseitigen Mediainfarktes stationär aufgenommen. Zuvor hatte sie bei Zustand nach alloprothetischem Aortenklappenersatz die Antikoagulationsbehandlung eigenständig beendet. Nach anfänglicher klinischer Stabilisierung kam es 3 Wochen nach Aufnahme zu einem erneuten Insultereignis mit rechtsseitigem Mediatotalinfarkt. Der weitere Verlauf erforderte zunächst eine Respiratortherapie. Nach anfänglicher enteraler Ernährungstherapie über eine nasogastrale Sonde wurde die Ernährung über eine PEG fortgeführt. Aufgrund rezidivierenden Erbrechens ab der 24. Schwangerschaftswoche wurde die PEG in eine JET-PEG umgewandelt. Mit diesem Zugang gelang dann unter gleichzeitiger Kontrolle per BIA die weitere Ernährungstherapie problemlos. In der 27. Schwangerschaftswoche erfolgte die Entbindung eines weiblichen Neugeborenen (Geburtsgewicht 820 g) als Sectio caesarea bei Präeklampsie. Die kindliche Entwicklung war zeitgerecht und im Weiteren unkompliziert. Die Mutter konnte unter Beibehaltung der enteralen Ernährungstherapie in die ambulante Pflege entlassen werden (56). Einheitliche Richtlinien über die enterale Ernährung Schwangerer liegen bisher nicht vor. Wir wählten eine vollbilanzierte, ballaststoffhaltige Standardsondennahrung und passten im Schwangerschaftsverlauf Energiegehalt, Eiweißmenge und Vitamingehalt bedarfsgerecht an. Die per BIA-Messung bestimmten Werte für Körperzellmasse, Extrazellulärmasse und Körperfett im Verlauf zeigt Abb. 4.9. Der Verlauf der Albuminspiegel im Serum (Abb. 4.10) mit dem physiologischen leichten Abfall im zweiten Drittel der Schwangerschaft kennzeichnet eine normale Ernährungssituation. Das nichtinvasive Verfahren der BIA-Messung wird zum Monitoring langzeiternährter Patienten erfolgreich angewandt.
Abb. 4.9 Bioelektrische Impedanzanalysen (BIA-Messungen) bei mittels JET-PEG (siehe Abb. 4.8) langzeiternährter Schwangerer mit apallischem Syndrom.
Abb. 4.10 Verhalten der Albuminspiegel im Serum bei derselben Patientin wie in Abb. 4.9. Es läßt Aussagen über Körpermasse, extrazelluläre Masse, Körperfett und Körperzellmasse als Parameter des Ernährungszustandes zu. Allerdings ist dieses Verfahren nur bei Gesunden und Patienten mit isolierter Störung des Ernährungszustandes hinreichend validiert, nicht dagegen bei Patienten mit deutlicher Hyperhydratation (Dialysepatienten, Patienten mit Aszites) wie auch in der Schwangerschaft. Hier sind das zusätzliche Kompartiment des Feten mit eigenem Zellanteil und der Fruchtwassergehalt zu berücksichtigen. Die zeitgerechte Entwicklung des Feten bis zur vorzeitigen Entbindung einhergehend mit einer stabilen Körperzellmasse und einer leicht ansteigenden Fettmasse der Mutter zeigt auf, daß die BIA-Messung zur Verlaufsbeurteilung der fetalen und maternalen Ernährungssituation offensichtlich geeignet ist. Ob eine regelmäßige BIA-Kontrolle bei Ernährungsstörungen in der Schwangerschaft sinnvoll und prognoseverbessernd ist, muß in weiteren Untersuchungen evaluiert werden. 4.4.2. Malassimilation, Diarrhoe Unter Maldigestion versteht man eine Einschränkung der intraluminalen Verdauung. Ätiologisch finden sich Störungen in der pankreatischen (z. B. exokrine Pankreasinsuffizienz) oder biliären Verdauungsphase (Mangel an Gallensäuren). Die Malabsorption ist durch gestörte Resorption und Abtransport digestiver Nahrungsendprodukte gekennzeichnet. Es können sehr heterogene Entstehungsursachen vorliegen wie Schleimhauterkrankungen (z. B. Laktasemangel, Sprue, Morbus Crohn) oder Reduzierung der Resorptionsfläche (z. B. Darmresektion, Ausschaltungsoperationen). Beide Funktionsstörungen faßt man unter dem Oberbegriff Malassimilation zusammen. Leitbefunde sind chronische Diarrhoen, Gewichtsverlust und Mangelsymptome. Die Diarrhoe ist Haupt- oder Begleitsymptom zahlreicher intestinaler, aber auch extraintestinaler Krankheiten. Verschiedene Definitionen werden benutzt, am häufigsten ist folgende: Absetzen von mehr als 3 flüssigen oder breiigen Stühlen/Tag mit einem Gewicht von über 200 g/Tag. Dauert die Diarrhoe länger als 2 Wochen, spricht man von einer chronischen Diarrhoe. Eine normale Funktion des Darms mit ungestörter Aufnahme von Eiweiß, Fetten, Kohlenhydraten, Vitaminen, Elektrolyten, Spurenelementen und Wasser gewährleistet das regelrechte Wachstum des Feten. Erkrankungen der Leber und Gallenwege, des Pankreas und des Magen-Darm-Kanals können jedoch zu einer Störung des Transports, der Digestion und Resorption dieser Nahrungsbestandteile führen und bei schweren Verlaufsformen den Feten gefährden. Die Symptomatik der Malassimilation wird dabei von der zugrundeliegenden Erkrankung bestimmt, häufiges Symptom ist die chronische Diarrhoe. Die chronisch entzündlichen Darmerkrankungen, Morbus Crohn und Colitis ulcerosa, sind wegen der Vielfalt möglicher Störungen von besonderer Bedeutung für unser Thema. Sie werden deshalb gesondert besprochen (s. Kap. 4.4.5.) Die einheimische Sprue (Zöliakie, glutensensitive Enteropathie) weist stärkere Wechselbeziehungen zur Gravidität auf. Die Sprue ist durch eine lebenslängliche Unverträglichkeit gegenüber dem Getreidebestandteil Gluten charakterisiert. Morphologisch findet sich eine Zottenreduktion und eine Kryptenhyperplasie der Dünndarmschleimhaut. Hieraus resultieren bei der manifesten Sprue eine Malabsorption und chronische Diarrhoen. Bei den häufigeren mono- oder oligosymptomatischen Formen können lediglich eine chronische Anämie oder die Beschwerdekonstellation eines Reizdarmsyndroms vorliegen. Mit dem Beginn einer glutenhaltigen Nahrung im Säuglings- und Kleinkindesalter kann sich die Erkrankung erstmals manifestieren. Ein erster Altersgipfel liegt im Kindesalter zwischen 9 Monaten und 3 Jahren, ein zweiter im 4. Lebensjahrzehnt. Die Prävalenz zeigt auch in Europa große Unterschiede, in Deutschland dürfte die Prävalenz bei Erwachsenen bei 1:5000 liegen. Die Fertilität ist bei aktiven Krankheitsprozessen reduziert. Die Schwangerschaft selbst kann die Symptomatik der Sprue verstärken oder zur Manifestation einer bislang asymptomatischen Erkrankung führen. Dies trifft vor allem für die Spätschwangerschaft und das Wochenbett zu. Beim unbehandelten Vollbild der Sprue ist sowohl die Zahl der Totgeburten als auch der Aborte erhöht. Diese erhöhte Inzidenz spontaner Aborte wird auf einen Folsäuremangel zurückgeführt. Aborte bei mikro- oder makrozytären Schwangerschaftsanämien sind, wenn keine andere Ursache gefunden wird, verdächtig auf das Vorliegen einer latenten Sprue, die deshalb differentialdiagnostisch ausgeschlossen werden muß. Das geburtshilfliche Hauptproblem ist allerdings im Rahmen der Sprue eine erhöhte fetale Wachstumsretardierung und möglicherweise auch eine gesteigerte Frühgeburtlichkeit, die wichtige Ursachen der neonatalen Morbidität und Mortalität darstellen. Ein entsprechendes pränatales Monitoring dieser Risikoschwangerschaften ist deshalb angezeigt (25). Die kausale Therapie besteht in der Elimination der toxischen glutenhaltigen Nahrungsprodukte. Mangelzustände (z. B. Vitamin B12, Folsäure, Zink, fettlösliche Vitamine) müssen ausgeglichen werden. Vor einer geplanten Schwangerschaft bei bekannter Sprue sollte angestrebt werden, dass sich die flache Dünndarmmukosa unter einer strikten glutenfreien Diät normalisiert und dass die Folgezustände der Malabsorption beseitigt worden sind. Aus einer kürzlich publizierten schwedischen Studie ergeben sich erste Hinweise, daß auch die behandelte einheimische Sprue negative Effekte auf Geburtsgewicht und Schwangerschaftsdauer ausüben kann. Es konnte gezeigt werden, daß nicht nur die Malnutrition als Risikofaktor anzusehen ist, sondern daß auch mit der Sprue assoziierte genetische Faktoren die fetale Prognose beeinflussen können. Bisher war bekannt, daß die gonodale Funktion des männlichen Sprue-Patienten reduziert ist. In dieser Studie konnte jetzt gezeigt werden, daß auch die ausschließliche Erkrankung des Vaters zu niedrigen Geburtsgewichten und eventuell auch zu einer Verkürzung der Schwangerschaftsdauer führen kann (37). Eine teilweise Ausschaltung des Dünndarms und damit Verringerung der Resorptionsfläche ist die Folge von intestinalen Bypass-Operationen, die zur Behandlung einer extremen Adipositas durchgeführt wurden. Obwohl gehäuft bei derartig behandelten Patientinnen Nebenwirkungen und Komplikationen auftreten, werden auch in Einzelfällen komplikationslose Schwangerschaften und Geburten beobachtet. Insgesamt muß jedoch aufgrund der sich entwickelnden Malabsorption gehäuft mit niedrigeren Geburtsgewichten, verkürzten Tragzeiten und intrauterinen Mangelentwicklungen gerechnet werden. Das gilt insbesondere für die jejunoilealen Bypass-Operationen, weniger für den gastralen Bypass (25). Die exsudative Gastroenteropathie ist durch einen verstärkten Verlust von Plasmaproteinen in den Intestinaltrakt mit nachfolgender Ausbildung von Ödemen, durch Gewichtsverlust und Infektionsneigung gekennzeichnet. Dieses polyätiologische Syndrom kann bei den verschiedensten Erkrankungen des Magen-Darm-Kanals, z.B. bei Sprue und bei Morbus Crohn und Colitis ulcerosa, auftreten und den Verlauf der Grunderkrankung komplizieren. Auch bei schwangerschaftsspezifischen Erkrankungen wie der Präeklampsie und der akuten Schwangerschaftsfettleber kann ein solcher pathologischer intestinaler Eiweißverlust auftreten (25). Das Reizdarm-Syndrom ist durch eine typische über Wochen bis Monate bis Jahre rezidivierende Beschwerdekonstellation mit diffusen Bauchschmerzen und Veränderungen der Defäkation (Diarrhoen, oft im Wechsel mit Obstipation) ohne faßbare organische Ursache charakterisiert. Gehäuft sind funktionelle Störungen des oberen Magen-Darm-Traktes (funktionelle Dyspepsie, Reizmagen-Syndrom) assoziiert. Beide Syndrome können sich überlagern bzw. abwechseln. Frauen, zumeist im 3. und 4. Lebensjahrzehnt, sind öfter als Männer von dieser häufigen funktionellen Darmstörung betroffen. Es existieren keine spezifischen Studien zur Prävalenz des Reizkolons während der Schwangerschaft. Wahrscheinlich ist die Symptomatik gleich häufig in wie außerhalb der Schwangerschaft. Den in der Schwangerschaft erhöhten Prostaglandinen wird eine wesentliche pathogenetische Rolle bei der Auslösung der Diarrhoen im Rahmen des Reizdarm-Syndroms zugeschrieben, indem sie die propulsiven Kontraktionen stimulieren und die Sekretion von Wasser und Elektrolyten steigern. Gleiche Effekte werden bei der exogenen Zufuhr von Prostaglandinen (z.B. Misoprostol) gesehen. Erhöhte Prostaglandinspiegel werden auch für die während der Menstruation zu beobachtenden Symptome wie Diarrhoe, Übelkeit, Erbrechen und abdominelle Beschwerden verantwortlich gemacht. Ein Laktasemangel, der sich bei etwa 15 % der weißen Bevölkerung findet, ist häufige Ursache von Diarrhoen, Meteorismus und Bauchkrämpfen, insbesondere nach Genuß größerer Mengen Milch. Die Laktosemalabsorption hat sowohl primär wie sekundär infolge diffuser Dünndarmerkrankungen (hier bestimmt die Schwere der Grunderkrankung die Prognose) keine größere Bedeutung für die Gravidität (25). Weniger bekannt, aber heute praktisch ebenso wichtig wie die Laktoseintoleranz, sind Unverträglichkeiten von Fruktose, Xylit und Sorbit, die als Süßstoffe Verwendung finden und ebenfalls Diarrhoen verursachen können. Zu Diarrhoen kann es auch bei Zufuhr hoher Mengen an Vitamin C (mehr als 3 – 4 g/Tag) als auch bei der Gabe von Magnesium-Präparaten kommen. Akute Diarrhoen werden auch in der Schwangerschaft meist durch Endotoxine sowie durch virale und bakterielle Infektionen hervorgerufen. Diese Diarrhoen heilen unter symptomatischer Therapie mit Flüssigkeitsersatz und Korrektur des Elektrolythaushaltes meist innerhalb weniger Tage ab. Aufgrund langjähriger Erfahrung ist die Gabe von Loperamid in der Schwangerschaft als relativ sicher anzusehen. Embryotoxische und teratogene Hinweise haben sich bisher nicht ergeben. Es wird kaum resorbiert und ist stärker wirksam als Diphenoxylat und besitzt auch nicht dessen opiatartige zentrale Nebenwirkungen. Bei schweren bakteriellen Darmerkrankungen wird auch in der Schwangerschaft die gezielte antibiotische Behandlung des Erregers durchgeführt (26). 4.4.3. Obstipation Die Obstipation ist ein Leitsymptom zahlreicher intestinaler und extraintestinaler Grunderkrankungen, keine Krankheit per se. Es überwiegen funktionelle Ursachen, selten sind es organische. Pathophysiologisch kann eine verzögerte Passage im Dickdarm oder eine Entleerungsstörung des Enddarms vorliegen. Bei der Darmträgheit stehen Beschwerden wie zu harter und zu seltener Stuhlgang, bei der Entleerungsstörung die Notwendigkeit starken Pressens und das Gefühl der unvollständigen Darmentleerung im Vordergrund. Wenn eine Defäkationsfrequenz von 3 – 21 Entleerungen pro Woche als normal angesehen wird, kann die Obstipation folgendermaßen definiert werden: - bei der akuten Obstipation haben die Betroffenen weniger als
6 Monate 2 oder weniger Darmentleerungen pro Woche und klagen über
Schwierigkeiten, die Entleerung einzuleiten, Die idiopathische Obstipation ist eine der häufigsten gastrointestinalen Funktionsstörungen. Die Prävalenzrate beträgt 2 % mit einer deutlichen Zunahme im Alter (bis zu 20 %). Es ist eine weit verbreitete Ansicht, daß auch für die Schwangerschaft die Obstipation geradezu typisch sei, die zudem mit Fortschreiten der Schwangerschaft zunehme und eine präexistente Obstipation verstärke. Im Gegensatz zu diesem mehr klinischen Eindruck sind wissenschaftliche Daten zur Prävalenz der schwangerschaftsassoziierten Obstipation relativ begrenzt, nicht zuletzt aufgrund des Fehlens allgemein akzeptierter Definitionen. Die Prävalenzen reichen von 11 % in Israel bis zu über 30 % in England im ersten, vor allem aber im letzten Trimenon (2, 6, 10, 25). Diese Unterschiede lassen sich zum Teil auf Ernährungs- und Umgebungsfaktoren in den verschiedenen Kulturbereichen zurückführen (10, 25). Vermutlich ist in Deutschland die Obstipation (nach eigenen Erfahrungen etwa 10 – 15 %) wie Übelkeit und Erbrechen und auch gastroösophageale Refluxbeschwerden eine relativ häufige Begleiterscheinung der Schwangerschaft. Zudem ist die Obstipation häufig Bestandteil des Reizdarm-Syndroms. Ebenso begünstigt sie das Auftreten von dyspeptischen und Refluxsymptomen. Die Pathophysiologie der schwangerschaftsbedingten Obstipation ist multifaktoriell. Eine ungenügende Flüssigkeitsaufnahme speziell bei Nausea und Emesis, die Ausbildung peripherer Ödeme sowie eine verlängerte Dünn- und Dickdarmtransitzeit mit konsekutiv vermehrter Resorption von Wasser und Elektrolyten können zur Eindickung des Stuhles führen, ein verringerter Ballaststoffverzehr, Einnahme von Eisenpräparaten wie von kalzium- und aluminiumhaltigen Antazida, mangelnde körperliche Bewegung, mechanische Effekte des wachsenden Uterus auf den Darm sowie eine Schwäche der Bauchmuskulatur und des Beckenbodens gerade bei Mehrgebärenden werden als weitere begünstigende Faktoren einer Obstipation angesehen. Ursachen von Defäkationsstörungen können u. a. ein Hämorrhoidalleiden, eine Analfissur oder eine perianale Thrombose sein. Bei der schwangerschaftsassoziierten Obstipation handelt es sich im wesentlichen um eine Verzögerung des intestinalen Transits, wobei ursächlich den ansteigenden Serumkonzentrationen von Östrogen und Progesteron und den abfallenden Spiegeln von Motilin (Progesteron soll die Freisetzung von Motilin hemmen) eine dominierende Rolle zukommt (6, 10, 15, 25). Ob das in Plazenta und Corpus luteum synthetisierte inhibitorische Polypeptid Relaxin ebenfalls eine, nach der Geburt reversible, allgemeine Tonusminderung der glatten Muskulatur hervorruft wie die anderen hormonellen Veränderungen, ist unklar. Tierexperimentelle Studien weisen auf die besondere Bedeutung des Progesterons in der Reduktion der muskulären Kontraktilität des gesamten Intestinaltraktes hin mit der Folge eines langsamen Transits. Ursächlich werden eine Änderung des transepithelialen Kalzium-Fluxes und/oder der intrazellulären Kalziumkompartimentierung diskutiert (10, 20). Transitzeitmessungen durch das Kolon (z.B. mit röntgendichten Markern) liegen aus verständlichen Gründen für die menschliche Schwangerschaft nicht vor. Es existieren lediglich Daten über die Transportgeschwindigkeit im Dünndarm mit Hilfe des Laktulose-H2-Atemtests. In einer Studie zeigte sich eine verlängerte orozökale Dünndarmtransitzeit, speziell im 3. Trimenon (Abb. 4.11).
Abb. 4.11 Orozökale Transitzeit während der Schwangerschaft und postpartal (35). Da dieser relativ unphysiologische Atemtest eine erhebliche intra- und interindividuelle Varianz aufweist, wird verständlich, daß andere Untersucher diesen Befund nicht bestätigen konnten (24, 35, 54). Die eigenen Normwerte bei nichtschwangeren Frauen während der Geschlechtsreife betragen 80 – 140 Minuten. Bei der Interpretation der orozökalen Transitzeit in der Schwangerschaft muss Berücksichtigung finden, dass das Ergebnis wesentlich von der Magenentleerung beeinflusst wird (z. B. häufigere Verlängerung der Magenentleerungszeit bei Schwangeren mit Sodbrennen) und dass die Laktulose selbst den Dünndarmtransit beschleunigt. Inkorrekt ist es, jede Obstipation als physiologische Begleiterscheinung der Schwangerschaft anzusehen. Gerade eine plötzlich aufgetretene Obstipation oder eine deutliche Symptomänderung bei chronischer Obstipation lassen es angebracht erscheinen, organische Ursachen (stenosierende Darmprozesse, anorektale Prozesse, endokrine und metabolische Ursachen, Erkrankungen der Nachbarorgane) durch entsprechende Untersuchungen (Endoskopie, Sonographie, Laboruntersuchung) auszuschließen. Eine seltene Komplikation in Schwangerschaft und Wochenbett ist die intestinale Pseudoobstruktion (Ogilvie-Syndrom) in der akuten oder chronischen Form. Es handelt sich um eine schwere Störung der Darmmotilität, die zum Auftreten ileusartiger Symptome (Ileus e graviditate) führt, ohne dass ein mechanischer Verschluss vorliegt. Ätiologisch werden bei diesem adynamischen (spastischen) Ileus u. a. eine übersteigerte physiologische Darmatonie, Elektrolytstörungen (z. B. bei Emesis), Albuminmangel mit Darmwandödem sowie die Kompression von Rektum und Sigma durch den Uterus vermutet. Liegen keine Zeichen einer Perforation vor, wird primär konservativ therapiert: koloskopische Dekompression, Gabe von Prokinetika, Korrektur von Volumen-, Albuminmangel und Elektrolytentgleisungen. Bei Vorliegen von organischen Ursachen der Obstipation muß, soweit möglich, kausal behandelt werden. Bei der funktionellen Form der Obstipation in der Schwangerschaft sollte versucht werden, therapeutisch mit den einfachsten Mitteln auszukommen. Dazu gehören Veränderungen der Lebensweise und der Nahrung (schlackenreiche Kost). Zu empfehlen sind gutbekömmliche Vollkorn-Getreidearten, frische und getrocknete Früchte, rohe und gekochte Gemüse und Salate, unterstützt durch eine reichliche Flüssigkeitszufuhr von 1,5 – 2 l Flüssigkeit. Bei Bedarf können Ballaststoffkonzentrate wie Füll- und Quellstoffe in einer Dosis bis zu 15 g/Tag hinzugefügt werden. Bei diesen Substanzen handelt es sich um natürlich vorkommende oder synthetisch abgewandelte quellfähige nichtverdaubare Polysaccharide. Hierzu gehören Inhaltsstoffe wie Leinsamen, Weizenkleie und indischer Flohsamen (Plantago ovata Samenschalen). Bei ungenügender Wirkung dieser milden Laxantien sind osmotisch wirksame Laxantien, speziell Laktulose als osmotisch wirksamer Zucker, angezeigt, aber auch die Gabe von Antrachinon-Derivaten (Sennoside) oder von Diphenylmethan-Derivaten (Bisacodyl, Natriumpicosulfat) ist gerechtfertigt. Weder bei Schwangeren noch aus Tierexperimenten sind embryotoxische oder fetotoxische Effekte dieser Substanzen bekannt geworden. Verboten sind dagegen Aloehaltige Abführmittel, die Aborte auslösen können. Zum Erreichen einer rektalen Entleerung sind CO2-produzierende Suppositorien oder Bisacodyl-Suppositorien als sicher anzusehen (26). 4.4.4. Anorektale Erkrankungen Von den verschiedenen anorektalen Erkrankungen haben während der Schwangerschaft besonders die Hämorrhoiden und ihre Folgeerscheinungen klinische Bedeutung. Entsprechend den zuführenden arteriellen Gefäßen entwickeln sich die Hauptknoten des hypertrophierten Corpus cavernosum recti in Steinschnittlage bei 3, 7 und 11 Uhr. Bei Hämorrhoiden 1. Grades ist die Hypertrophie des Hämorrhoidalorgans proktoskopisch oberhalb der Linea dentata sichtbar, bei Hämorrhoiden 2. Grades prolabieren die Knoten auf Bauchpresse und bei der Defäkation in den Analkanal, um sich dann spontan zu retrahieren, bei den Hämorrhoiden 3. Grades sind die fibrosierten Knoten bereits von außen sichtbar, lassen sich aber noch digital reponieren, bei Hämorrhoiden 4. Grades dagegen besteht ein permanenter nicht reponibler Hämorrhoidalprolaps. Etwa die Hälfte der Schwangeren entwickelt mit zunehmender Schwangerschaft innere Hämorrhoiden, wobei es sich überwiegend um die Schweregrade 1 und 2, nur selten um Grad 3 handelt. Besonders betroffen sind ältere Schwangere und Mehrgebärende. Etwa 65 – 85 % der Frauen mit Hämorrhoidalbeschwerden geben an, daß sich die Symptomatik erstmals während der Schwangerschaft entwickelt habe. Bei vorbestehenden Hämorrhoiden kommt es etwa in 85 % der Fälle während Schwangerschaft und Entbindungsphase zur Verschlechterung (10, 25). Als begünstigende pathogenetische Faktoren werden die hormonell bedingte Steigerung des arteriellen Zuflusses und die Hemmung des venösen Abflusses durch den erhöhten Druck im kleinen Becken gegen Ende der Schwangerschaft, durch den vergrößerten Uterus und durch verstärktes Pressen infolge einer zunehmenden schwangerschaftsassoziierten Obstipation diskutiert. Leitsymptom des Hämorrhoidalleidens, vor allem bei Schweregrad 1, ist die hellrote Blutung. Auch wenn die Hämorrhoidalregion die häufigste Ursache peranaler Blutungen ist, müssen auch in der Schwangerschaft differentialdiagnostisch chronisch entzündliche Darmerkrankungen, Karzinome und Polypen endoskopisch ausgeschlossen werden. Weitere Symptome wie Juckreiz, Schmerzen, Brennen und Stechen in der Analregion, Fremdkörper- und Druckgefühl, Sekretion aus dem After, akutes und chronisches Analekzem, Prolaps und akute äußere perianale Thrombosen sind mehrheitlich Zeichen der fortgeschrittenen Erkrankung oder von Sekundärkomplikationen. Besonders schmerzhaft sind die akuten perianalen Thrombosen, die vor allem im Wochenbett auftreten. Nicht mit Hämorrhoiden verwechselt werden dürfen Analläppchen (Marisken), die während Schwangerschaft und postpartal durch eine lokale Entzündung ein ausgeprägtes Ödem entwickeln können. Bei Pruritus ani muß auch an das Vorliegen eines Diabetes mellitus oder einer Oxyuren-, Soor- oder Trichomonadeninfektion gedacht werden. Die Therapie des unkomplizierten Hämorrhoidalleidens ist primär konservativ. Sie besteht in der Durchführung von allgemeinen Maßnahmen (ballaststoffreiche Kost, ausreichend Flüssigkeit, körperliche Bewegung) sowie einer lokalen symptomatischen Behandlung mit antiphlogistischen, adstringierenden und anästhesierenden Salben und Suppositorien. Die perianale Thrombose kann in den ersten Tagen durch Stichinzision und Expression der Thromben - häufig ohne Lokalanästhesie möglich – oder durch eine ovaläre Exzision des Knotens in Lokalanästhesie behandelt werden. Bei ausgedehnten perianalen Thrombophlebitiden, bei denen es nicht gelingen dürfte alle Thromben nach der Inzision zu entfernen, oder bei bereits in Organisation übergegangenen Thrombosen empfehlen sich abschwellende Maßnahmen wie Kochsalzumschläge oder lokale Anwendung von Heparinoiden oder Lokalanästhetika, in schweren Fällen ist auch die Gabe von Antiphlogistika wie Diclofenac gerechtfertigt. Mit den bisher aufgeführten Maßnahmen läßt sich das Hämorrhoidalleiden während der Schwangerschaft und im Wochenbett in den meisten Fällen gut beherrschen. Die Indikation zur operativen Hämorrhoidektomie, auch noch im Wochenbett, ist sehr zurückhaltend zu stellen, da selbst ausgeprägte Veränderungen oft eine überraschend gute Rückbildungstendenz zeigen. Über eine gezielte Behandlung sollte frühestens 2 Monate post partum entschieden werden. Nur schwerere Blutungen, Prolaps und rezidivierende Thrombosen lassen eine sofortige kausale Therapie nach den bekannten Richtlinien angebracht erscheinen. Nur in Ausnahmefällen, bei massivem Anal- und Hämorrhoidalprolaps oder beim Rektumprolaps ist eine chirurgische Korrektur erforderlich, die ebenfalls vorzugsweise nach dem Wochenbett durchgeführt werden sollte (25, 45). In der Schwangerschaft auftretende akute Analfissuren, für deren Entstehen innere Hämorrhoiden als Teilursache angesehen werden, die fast immer – häufig mit einer Vorpostenfalte – an der hinteren Kommissur lokalisiert sind und die sich durch einen außerordentlich heftigen mit der Defäkation beginnenden Schmerz auszeichnen, werden therapeutisch durch Unterspritzung mit Lokalanästhetika angegangen. Nur chronische Fissuren sollten in Lokalanästhesie exzidiert werden (25). 4.4.5. Chronisch entzündliche Darmerkrankungen (CED) Morbus Crohn (MC) und Colitis ulcerosa (CU) sind die Hauptformen der idiopathischen chronisch entzündlichen Darmerkrankungen (CED). Sie weisen eine Reihe von Gemeinsamkeiten auf, Unterschiede bestehen vor allem im makroskopischen und histologischen Befund sowie im Befallsmuster. Der Begriff Colitis indeterminata kennzeichnet die Fälle, deren exakte Zuordnung nicht möglich ist (ca. 10 % der Patienten). Die Inzidenz der CED zeigt in den verschiedenen geographischen Regionen große Unterschiede. In Westeuropa beträgt die Inzidenz derzeit 1 – 6 pro 100.000 Einwohner und Jahr bei einer Prävalenz von 10 – 100. Der MC kann diskontinuierlich den gesamten Magen-Darm-Trakt befallen. Alle Wandschichten sind vom Entzündungsprozeß betroffen mit der Folge des komplizierenden Auftretens von Stenosen, Fisteln und Abszessen. Prädilektionsorte sind Ileum, Kolon und Perianalregion. Die CU zeigt in der Regel einen kontinuierlichen Befall ausschließlich der Kolonmukosa. Überwiegend sind die distalen Kolonabschnitte betroffen. Ausgehend vom Rektum kann die Entzündung aber auch unterschiedlich weit das gesamte Kolon, gelegentlich das terminale Ileum, erfassen. In etwa 10 % der Fälle findet sich eine totale CU. In der Regel wechseln sich akut entzündliche Schübe mit Remissionsphasen ab. Das klinische Bild bei MC ist sehr variabel, abhängig von Lokalisation und Ausmaß der Entzündung. Häufige Symptome sind Durchfälle (meist ohne Blut), Gewichtsverlust, Bauchschmerzen und Fieber. Führende Symptome bei der CU sind die blutig-eitrig-schleimigen Durchfälle, Gewichtsabnahme und Fieber treten je nach Aktivität der Erkrankung hinzu. Ätiologie und Pathogenese der CED sind weiterhin noch nicht völlig geklärt. Eine genetische Prädisposition, noch nicht eindeutig identifizierte Umwelteinflüsse (z.B. Rauchen, Ernährung, Infektionen etc.) und Wirtsfaktoren (z. B. gestörte intestinale Barrierefunktion) werden als Faktoren diskutiert, die an der Fehlregulation und pathologischen Steigerung der Immunantwort der mukosaassoziierten Immunzellen ursächlich beteiligt sind. Als Hinweis für den systemisch-immunologischen Charakter der CED finden sich gehäuft extraintestinale Manifestationen an Haut, Gelenken, Auge, Leber, Gallenwegen und anderen Organen. Differentialdiagnostisch müssen die CED von infektiösen Darmerkrankungen abgegrenzt werden. CED manifestieren sich überwiegend im Jugend- und frühen Erwachsenenalter zwischen dem 15. und 30. Lebensjahr, das Geschlechtsverhältnis ist in etwa ausgeglichen. Somit ist bei vielen der erkrankten Frauen während der gesamten Zeit der Geschlechtsreife die Möglichkeit einer wechselseitigen Beeinflussung der CED mit Fertilität und Schwangerschaft gegeben. Zu fragen ist aber auch, ob die männliche Fertilität durch die Erkrankung selbst, aber auch durch Medikamente und operative Eingriffe beeinflußt werden kann. 4.4.5.1. Fertilität Die Fertilität von Frauen mit CED ist in der Regel nicht beeinträchtigt, dies gilt insbesondere für Patientinnen mit geringer Krankheitsaktivität und fehlenden Komplikationen. In Phasen mit hoher entzündlicher Aktivität, nach größeren operativen Eingriffen oder ausgeprägten Gewichtsverlusten kann jedoch – aus biologischer Sicht durchaus sinnvoll – die Konzeptionsfähigkeit vorübergehend oder dauerhaft herabgesetzt sein, z.B. bei sekundärer Amenorrhoe (1, 25, 29, 31, 34). Eine Sonderstellung nehmen Frauen mit CU ein, bei denen eine Proktokolektomie mit ileoanaler Pouchanlage durchgeführt wurde. In einer umfangreichen dänisch-schwedischen Studie mit 290 Patientinnen, die im Alter von 10 – 40 Jahren operiert wurden, nahm die Fertilität verglichen mit einem Kontrollkollektiv von 661 Frauen ohne CED um 80 % ab. Vor dem operativen Eingriff entsprach die Fertilität der einer gesunden Kontrollpopulation. Die Gründe für diese deutliche Reduktion der Fertilität sind unklar, auf adhäsive Veränderungen im kleinen Becken als eine mögliche Ursache wird hingewiesen (42). Beim Vorliegen eines aktiven MC scheint die Fertilität insgesamt vermindert zu sein. Dyspareunie, unregelmässige Ovulationszyklen, verminderte Libido sowie chronische Entzündungsprozesse, Abszesse und Fisteln im Becken, die die Funktion von Tuben, Ovarien, Uterus und Vagina beeinträchtigen, können verantwortlich gemacht werden. Bei Männern können Salazosulfapyridin-Präparate zu einer reversiblen Infertilität führen. Ursache sind Oligospermie und Alterationen der Spermienmorphologie und –motilität. Nach Absetzen von Sulfasalazin oder beim Wechsel auf 5-Aminosalicylsäure-Präparate bildet sich die Infertilität nach etwa 2 Monaten zurück. Während die Proktokolektomie im Allgemeinen die Fertilität nicht beeinflußt, können Fisteln und Abszesse im kleinen Becken zu Erektions-und Ejakulationsstörungen führen (29, 31). 4.4.5.2. Wechselwirkungen zwischen CED und Schwangerschaft Alle Studien, die die Wechselwirkungen zwischen CED und Schwangerschaft behandeln, stellen in der Regel retrospektive Studien, häufig mit relativ kleiner Fallzahl dar. Dass teils Angaben über die genauen Krankheitslokalisationen fehlen, unterschiedliche therapeutische Maßnahmen zur Anwendung kamen, Verlaufsbeobachtungen an Kontrollgruppen gleichaltriger nichtgravider CED-Patientinnen nicht durchgeführt wurden, erschwert die Beurteilung der Zusammenhänge. Basierend auf Sammelstatistiken und Metaanalysen wird heute im Gegensatz zu früheren Auffassungen - eine Gravidität beeinflusse den Verlauf der CED negativ - angenommen, dass der Verlauf der CED weitgehend unabhängig von der Schwangerschaft ist und dass der Schwangerschaftsverlauf bei MC und CU in 70 – 80 % unkompliziert ist. Letztendlich bestimmen Art, Ausdehnung und Schwere der zugrundeliegenden CED, die Aktivität zum Zeitpunkt der Konzeption, aber auch psychologische Faktoren den Krankheitsverlauf während der Gravidität (1, 25, 27, 29, 31, 34). Erfolgt die Konzeption bei CU und MC in der Remissionsphase, verläuft die Schwangerschaft in der Regel ungestört, drei Viertel der Schwangeren erleiden keine Exazerbation. Etwa zwei Drittel der Patientinnen, die während einer aktiven Phase der Erkrankung schwanger werden, müssen damit rechnen, daß die Aktivität gleich schlecht bleibt oder sogar schlechter wird, und daß nur ein Drittel auch bei adäquater Behandlung eine Remission erreicht. Entzündliche Schübe treten bevorzugt im ersten Trimenon und im Wochenbett auf, also in Phasen hormoneller Umstellung, in denen gerade auch psychosomatische Einflüsse wirksam werden können. Der Einfluß psychischer Faktoren wird auch an der Beobachtung deutlich, daß ungewollte Schwangerschaften gegenüber gewünschten Schwangerschaften mit 39 % versus 12 % eine höhere Rezidivrate aufweisen (29, 48). Es ist ungeklärt, ob bei medikamentös-induzierten Remissionen oder bei den wiederholt gesehenen Spontanremissionen der Anstieg des Kortisols während der Schwangerschaft oder der Einfluss des epidermal growth factor (EGF) eine Rolle spielen. In einer präliminären Studie finden sich Hinweise, dass lokal applizierter epithelialer Wachstumsfaktor zusammen mit Mesalazin eine neue Therapieoption für die linksseitige CU sein könne. Es ist die Frage, ob die geringe endogene Produktion von EGF im Dünn- und Dickdarm, die bei den CED wahrscheinlich keine Änderung erfährt, hier in der Schwangerschaft stimuliert wird. Nach Proktokolektomie und Anlage eines Ileostomas ist das Austragen einer Schwangerschaft ungestört möglich, so dass kein Grund besteht, in einem solchen Fall von einer Schwangerschaft abzuraten. Die Funktion des Stomas bleibt in den meisten Fällen unbeeinflußt, mögliche Komplikationen sind in der zweiten Schwangerschaftshälfte ein Prolaps des Ileums durch das Stoma, eine intestinale Obstruktion durch das Wachstum des Uterus und die intraabdominelle Druckerhöhung sowie Blutungen aus Einrissen des Ileostomas. Nach ileoanaler Pouchanlage kann es während der Schwangerschaft gehäuft zu Problemen mit dem Pouch kommen. Die zu beobachtenden erhöhten Stuhlentleerungsfrequenzen und Inkontinenz sind post partum meist reversibel. Bei MC-Patientinnen mit aktiver perianaler Beteiligung wird die Entbindung per Kaiserschnitt empfohlen, um Komplikationen wie verzögerte Wundheilung und Ausbildung von Fisteln oder Abszessen zu vermeiden. Bei Patientinnen mit ileoanalem Pouch ist in der Regel eine vaginale Entbindung möglich (29, 34, 42, 44). Bei CED liegt die Chance, ein lebendes und gesundes Kind zu gebären,
im Mittel über 80 % (71 – 97 % in individuellen Untersuchungen),
und ist damit normal. Auch die Rate an Spontanaborten (ca. 7,5 –
10 %), Mißbildungen (im Mittel 1 %) und Totgeburten (ca. 1
– 2%) Die Häufung von MC und CU in einzelnen Familien und Untersuchungen an ein- und zweieiigen Zwillingen weisen auf einen Einfluß des Erbmaterials auf die Entwicklung dieser CED hin. Das Lebenszeitrisiko für Kinder von Patienten mit CED selbst zu erkranken ist relativ gering. Ist ein Elternteil an einer CED erkrankt, liegt das relative Risiko für die Kinder weit unter 10 % (1- 7 %). Leiden hingegen beide Eltern an einer CED, ist das Risiko für die Kinder überproportional hoch (bis 36 %). Bei einem erkrankten Kind liegt das relative Risiko für weitere Geschwister, ebenfalls zu erkranken, bei 2 – 6%. Insgesamt scheint die genetische Prädisposition bei MC deutlich höher zu sein als bei der CU (31). Trotz dieser erblichen Belastung wird erkrankten Eltern nicht von der Realisierung des Kinderwunsches abgeraten. Wenn die CED frühzeitig erkannt und adäquat behandelt werden, unterscheidet sich heute die Lebenserwartung Erkrankter nicht signifikant von der Lebenserwartung Gesunder (29, 31). 4.4.5.3. Therapie Vor einer geplanten Schwangerschaft sollten bereits die Artdiagnose der CED festgelegt und Aktivität und Ausdehnung bestimmt sein. Ebenso müssen Komplikationen wie Stenosen, Fisteln, Abszesse und Konglomerattumoren ausgeschlossen werden, um eine in der Schwangerschaft erforderliche chirurgische Intervention möglichst zu vermeiden. Zu jedem Zeitpunkt der Schwangerschaft können jedoch ebenfalls die meisten diagnostischen Verfahren (Laboruntersuchungen, Ultraschall, Endoskopie) z. B. bei Erstmanifestation, beim Auftreten von Komplikationen oder bei notwendig werdender Verlaufskontrolle eingesetzt werden. Wenn möglich ist der Sigmoidoskopie der Vorzug zu geben, z.B. bei der CU. Eine Ileo-Koloskopie sollte auf die Fälle beschränkt bleiben, in denen der Befund Auswirkungen auf das therapeutische Vorgehen erwarten läßt wie bei massiver Blutung oder endoskopischer Dilatation von Stenosen. Charakteristisch für die CED ist, daß sich Remissionsphasen mit Phasen erhöhter entzündlicher Aktivität abwechseln. Ziel jeder Therapie muß es daher sein, möglichst lange Remissionsphasen zu erzielen. Auch eine Schwangerschaft sollte möglichst in der Remissionsphase geplant werden, um insbesondere die Rate von Früh- und Fehlgeburten zu senken. Besteht zum Zeitpunkt der Konzeption oder in der Frühphase der Schwangerschaft eine stabile Remission, kann sogar versucht werden, auf Medikamente zur Rezidivprophylaxe zu verzichten. Beim rezidivierenden Verlauf mit akuten Schüben ist jedoch auch in der Schwangerschaft die Pharmakotherapie indiziert. Grundsätzlich werden Schwangerschaftsverlauf und Fetus durch eine hohe Krankheitsaktivität mehr gefährdet als durch die Standardmedikation. Aufgrund der noch nicht ausreichend bekannten Ätiopathogenese existiert derzeit keine kausale Therapie. Kortikosteroide und Aminosalizylate (5-ASA) als Standardsubstanzen hemmen unspezifisch die Entzündungsreaktionen in der Mukosa. In besonderen klinischen Situationen ist der Einsatz von Medikamenten mit spezifischeren Angriffspunkten (Immunsuppressiva und Immunmodulatoren) zu erwägen. Bei den zur Verfügung stehenden vielfältigen Therapieoptionen werden auch bei den CED Step-up- und Step-down-Prinzip als stufenweise eskalierende oder als möglichst frühe aggressive Therapieansätze diskutiert. Für die Schwangerschaft gilt ausschließlich das Step-up-Prinzip, wobei auch hier Kortikosteroide und Aminosalizylate in üblicher Dosierung als sichere Standardsubstanzen gelten, die gegebenenfalls von der Konzeption bis zum Wochenbett kontinuierlich gegeben werden können. Das therapeutische Vorgehen richtet sich einerseits nach der Lokalisation und vor allem nach der Aktivität der Erkrankung, andererseits nach dem Krankheitsverlauf. Die Gabe von Kortikosteroiden und Aminosalizylaten hat weder auf den Verlauf der Schwangerschaft noch auf die Inzidenz fetaler Komplikationen wie Spontanabort, Totgeburt, Frühgeburt und kongenitale Mißbildungen einen nachteiligen Einfluß. Sulfasalazin (SASP), das ausschließlich im Kolon wirkt, hemmt Transport und Metabolismus von Folsäure. Um Neuralrohrdefekte zu vermeiden, muss daher Folsäure (2 mg/Tag) substituiert werden. Metronidazol gilt in höheren Dosen und bei längerer Anwendung als potentiell teratogen und karzinogen. Aufgrund der begrenzten Erfahrungen beim Menschen sollte ein Einsatz nur in streng indizierten Ausnahmefällen erwogen werden. Die meisten klinischen Erfahrungen mit einer Immunsuppression durch Azathioprin oder dem Metaboliten 6-Mercaptopurin in der Schwangerschaft liegen aus Transplantationsmedizin und Rheumatologie, weniger bei den CED, vor. Bisher wurden keine negativen Auswirkungen auf Mutter oder Kind beobachtet. Die Medikation sollte daher auch während der Schwangerschaft nicht unterbrochen werden (1, 25, 29, 31, 34, 40). Wahrscheinlich bedeutet das Absetzen der remissionserhaltenden Therapie ein höheres Risiko als die Fortführung der Medikation. Da geringe Mengen von Azathioprin in die Muttermilch übertreten, wird vom Stillen abgeraten. In die Diskussion über Vor- und Nachteile einer derartigen Therapie sollten die Eltern entscheidend einbezogen werden. Auch wenn es immer wieder Mitteilungen über normal entwickelte Feten gibt, sollten bei der limitierten Datenlage andere Therapeutika wie Infliximab, Methotrexat, Cyclosporin, Tacrolimus etc. derzeit generell in der Schwangerschaft nicht zum Einsatz kommen (3, 18, 29, 47). In der Regel sprechen nahezu alle CED auch in der Schwangerschaft auf eine konsequent durchgeführte Therapie mit Kortikosteroiden und 5-ASA-Präparaten als Standardmedikamente an. CED stellen keine Kontraindikation für eine Schwangerschaft dar und ebenso besteht keine medizinische Indikation für eine Interruptio. Nur in absoluten Notfällen, z. B. bei schwerer Blutung, bei Perforation, bei komplettem Ileus oder therapieresistentem toxischen Megakolon ist die Operationsindikation gegeben. 4.4.6. Intestinale Tumoren Benigne wie maligne Tumoren des Dünn- und Dickdarms treffen nur in seltenen Ausnahmefällen mit einer Schwangerschaft zusammen. So liegen Einzelberichte von Karzinomen und Sarkomen des Jejunums, von Karzinoiden der Appendix und des Rektums und von familiärer adenomatöser Polyposis (FAP) des Kolons (5, 13, 25, 28, 55) vor. Die FAP weist einen genetischen Defekt auf dem Chromosom 5 auf, der mehrere Neoplasien auslösen kann, vor allem kolorektale Karzinome und Desmoide. Bei den Desmoiden gehören auch hormonelle Einflüsse zu den Wachstumsfaktoren. Entsprechend wurden Desmoide bei Frauen im zeitlichen Zusammenhang mit einer Gravidität beobachtet. Die umfassende Therapie der Desmoide kann erst nach der Schwangerschaft erfolgen. Das Entartungsrisiko der FAP soll durch eine Schwangerschaft beschleunigt werden (28). Insgesamt sind die kolorektalen Karzinome, von denen einige hundert Fälle publiziert sind, die häufigste Tumorart während der Schwangerschaft. Dabei handelt es sich überwiegend um Rektumkarzinome, seltener um Kolonkarzinome. Es sind vorwiegend ältere Schwangere betroffen, aber auch bei jüngeren muss mit der Möglichkeit gerade eines Rektumkarzinoms gerechnet werden. Bei den bisherigen Beobachtungen wurde die Diagnose fast immer sehr spät gestellt, da uncharakteristische Frühsymptome häufig fehlgedeutet wurden und da Blutungen und Stuhlverhaltung als Hämorrhoidalblutungen oder Schwangerschaftsobstipation angesehen wurden. Da eine digital-rektale Untersuchung häufig nicht ausreicht, sollte heute die Koloskopie integraler Bestandteil der Untersuchung sein. Die Problematik verdeutlicht auch eine eigene Beobachtung. Bei einer 41-jährigen Schwangeren wurde bei unauffälligem Tastbefund die Hämorrhoidalregion als Ursache der peranalen Blutungen angesehen. Im 7. Monat erfolgte schließlich endoskopisch und histologisch in 13 cm Höhe der Nachweis eines Adenokarzinoms des Rektums. Vier Wochen später schloss sich die erfolgreiche Kombination von Schnittentbindung und Operation an. Die Schwangerschaft beeinflusst den Verlauf der Karzinomerkrankung nicht, die Prognose der Schwangeren wird vom Ausbreitungsgrad des Karzinoms bestimmt. Mit der Diagnose des Karzinoms ist unabhängig vom Zeitpunkt der Schwangerschaft die Indikation zum chirurgischen Eingriff gegeben, wobei auch hier die Kriterien der Tumorchirurgie gelten. In den letzten beiden Schwangerschaftsmonaten kann die operative Therapie mit einer Sectio verbunden werden. Bei inoperablem Tumor wird ein Palliativeingriff durchgeführt und die Gravidität erhalten. Da Diagnose und Therapie oft erst im fortgeschrittenen Stadium erfolgen, ist die mütterliche Prognose entsprechend schlecht (5, 13, 25, 55). 4.5. Literatur
|
|||||||||||